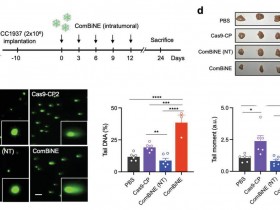
1、Nature:单线态分子氧调节炎症条件下的血管张力和血压
影响因子:41.577
2019年2月13日,澳大利亚新南威尔士大学Stocker团队发表研究论文,论文显示动脉表达的吲哚胺2,3-双加氧酶通过形成1O2调节血压。
单线态分子氧(1O2)在光合作用植物,细菌和真菌中具有良好的作用,但在哺乳动物中没有。化学产生的1O2将色氨酸氧化成称为N-甲酰基犬尿氨酸的关键代谢物的前体,而色氨酸酶氧化成N-甲酰基犬尿氨酸由一系列双加氧酶催化,包括吲哚胺2,3-双加氧酶。在炎症条件下,这含血红素的酶在动脉内皮细胞中表达,在那里它有助于调节血压。然而,吲哚胺2,3-双加氧酶(IDO1)是否形成1O2以及这是否有助于血压控制仍然未知。
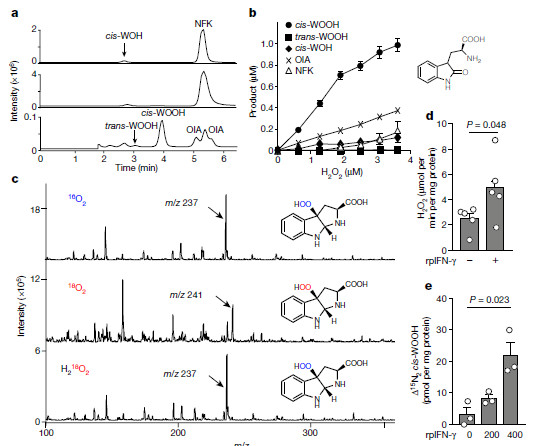
图片来自Nature(机制的发现)
已经证明,在表达吲哚胺2,3-双加氧酶(IDO1)的炎性条件下,1O2在哺乳动物的动脉舒张和血压的氧化还原调节中具有重要的病理生理作用。
该论文显示动脉表达的吲哚胺2,3-双加氧酶通过形成1O2调节血压。研究人员发现,在过氧化氢存在下,酶产生1O2,之后将L-色氨酸立体选择性氧化成三环氢过氧化物,同血压的调节有关。色氨酸衍生的氢过氧化物在体内作为信号分子起作用,诱导动脉松弛和降低血压;该活性依赖于蛋白激酶G1α的Cys42。研究结果证明了1O2在哺乳动物中的病理生理作用是通过形成氨基酸衍生的氢过氧化物来调节炎症条件下的血管张力和血压。
评论:研究结果证明了1O2在哺乳动物中的病理生理作用是通过形成氨基酸衍生的氢过氧化物来调节炎症条件下的血管张力和血压。
文章来源:
Christopher P. Stanley,et al.Singlet molecular oxygen regulates vascular tone and blood pressure in inflammation.Nature.13 February 2019
2、Nature:揭示RNA m6A修饰调控抗肿瘤免疫机制
影响因子:41.577
中国科学院北京基因组研究所韩大力团队与清华大学徐萌团队、美国芝加哥大学何川团队合作发现,RNA m6A修饰通过调控树突状细胞的溶酶体组织蛋白酶翻译效率,影响肿瘤抗原特异性的T细胞免疫应答新机制。
m6A修饰是mRNA上丰度最高的修饰类型,负责对mRNA分子进行转录后调控。m6A修饰通过其结合蛋白YTHDF1影响下游基因的翻译效率。韩大力及其合作者发现,RNA m6A修饰通过YTHDF1调控肿瘤抗原特异性免疫反应。相比于野生型小鼠,Ythdf1敲除小鼠展现出较强的肿瘤抗原特异性CD8+T细胞应答。进一步研究表明,体内删除树突细胞中的YTHDF1会提升其对肿瘤抗原的交叉呈递能力和T细胞的交叉激活。结合m6A-Seq、Ribo-Seq等转录组学数据发现,多个树突细胞溶酶体组织蛋白酶的转录本均带有m6A修饰且被YTHDF1识别,进而促进其翻译效率。同时,使用组织蛋白酶的抑制剂可以有效增强野生型DC细胞的交叉呈递能力。
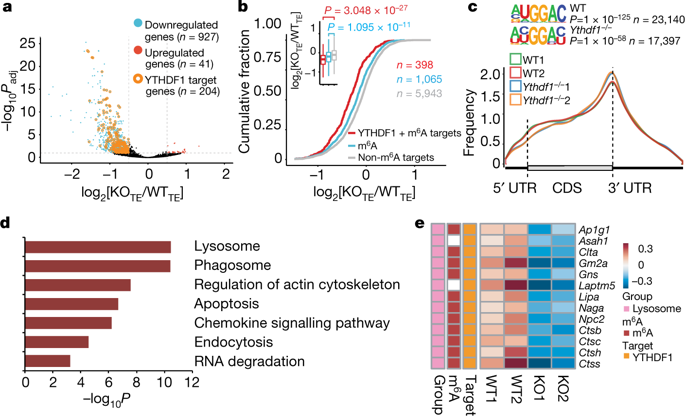
图片来自Nature(全转录组YTHDF1结合位点的识别和分析)
研究人员进一步在其小鼠肿瘤模型中发现,Ythdf1敲除小鼠携带的肿瘤中PD-L1基因表达具有明显上调。PD-L1阻断疗法在Ythdf1敲除小鼠的治疗效果亦有大幅提升。结肠癌病人样本中的研究结果与小鼠模型相一致:肿瘤基质细胞中YTHDF1表达较低的肿瘤样本中含有较多的T细胞浸润。
评论:增强抗肿瘤反应新方法,可让癌症对免疫疗法的反应率提高至将近100%
文章来源:
Dali Han,et al.Anti-tumour immunity controlled through mRNA m6A methylation and YTHDF1 in dendritic cells.Nature.566, pages270–274 (2019)
影响因子:41.577
Jennifer Doudna团队发现新型CRISPR基因组编辑酶,一种能调控人类基因组的新型酶CasX,其编辑功能与先前已描述的CRISPR–Cas系统都不相同
美国加州大学伯克利分校的Jennifer Doudna与同事从地下水的微生物中分离得到了一种此类核酸酶,称其为CasX。CasX的一大重要应用特点在于其比Cas9或Cas12a都要小得多(不到1000个氨基酸)。分析显示,CasX能同时修饰人类和大肠杆菌的基因组。
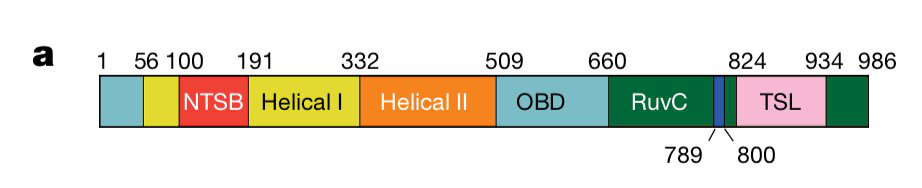
图片来自Nature(CasX的结构组成)
研究人员指出,CasX编辑DNA的机制与Cas9或Cas12a的机制在功能上存在差异。CasX的结构具有其它Cas蛋白中未曾发现的特征,比如含有一个参与DNA解螺旋的结构域;其反式切割活性似乎也比其它Cas系统要少。
CasX不仅小巧,还具有独特的可编程编辑方式,或具备目前CRISPR–Cas基因组编辑技术所没有的优势。
评论:这为CRISPR工具箱再添一员,新型CRISPR基因组编辑酶CasX
文章来源:
Jun-Jie Liu, Natalia Orlova, Benjamin L. Oakes, et al. CasX enzymes comprise a distinct family of RNA-guided genome editors. Nature. Feb 2019.