1.Nature Biotechnology:新的CRISPR C-G DNA碱基编辑器
2020年7月20日,来自哈佛医学院J. Keith Joung和Julian Grünewald小组合作在《自然—生物技术》杂志上发表了标题为“CRISPR C-to-G base editors for inducing targeted DNA transversions in human cells.”的研究论文,他们开发出CRISPR C-G碱基颠换工具,能够编辑诱导目标在人类细胞中DNA颠换。
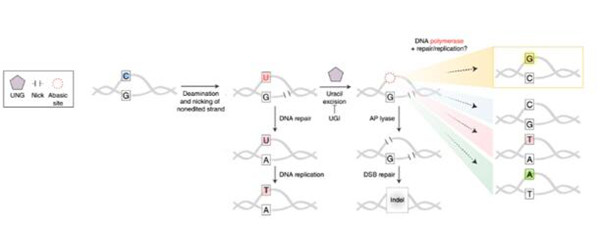
Fig. 1: 胞嘧啶(C)脱氨基突变后的修复情况示意图
研究团队通过对两种碱基编辑器结构的改造,有效地诱导目标C-G碱基颠换,同时减少了不必要的C-W(W = A或T)和插入缺失突变(indel)。其中一个C-G碱基编辑器(CGBE1),包含RNA介导 Cas9 nickase,以大肠杆菌为基础的尿嘧啶DNA糖基化酶 (eUNG)和以大鼠APOBEC为基础的胞嘧啶核苷脱氨酶突变体(R33A)(过去工作证明该突变体能够降低RNA和DNA编辑中的脱靶效应)。
研究团队表明,CGBE1可以有效地诱导C到G的编辑,尤其是在人类细胞中富含AT的序列中。通过删除CGBE1中的eUNG域,课题组得到了miniCGBE1,降低了插入缺失突变的频率,而编辑效率仅略有减少。CGBE1和miniCGBE1成功实现C-G编辑,并为优化C-G碱基编辑的研究和治疗应用提供了基础。
研究人员表示,CRISPR介导的DNA胞嘧啶和腺嘌呤碱基编辑工具具有广泛应用,但主要是进行DNA碱基转换(即嘧啶-嘧啶或嘌呤-嘌呤)。
(评论:在单碱基编辑工具研究中取得进展。)
文章来源:
Ibrahim C. Kurt, Ronghao Zhou, CRISPR C-to-G base editors for inducing targeted DNA transversions in human cells. DOI: 10.1038/s41587-020-0609-x Nature Biotechnology:最新IF:31.864
2、Cell: 研究揭示不同细胞类型如何调控鸡皮疙瘩的产生
2020年7月16日,来自美国哈佛大学Ya-Chieh Hsu、中国台湾大学Sung-Jan Lin等研究人员合作在《细胞》杂志上发表了标题为“ Cell Types Promoting Goosebumps Form a Niche to Regulate Hair Follicle Stem Cells.”的研究成果,揭示不同细胞类型如何调控鸡皮疙瘩的产生。
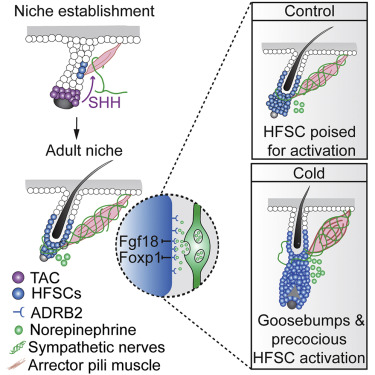
Fig 2.来自cell
研究人员发现,立毛肌(APM)和交感神经形成双组分微环境来调节毛囊干细胞(HFSC)活性。交感神经与HFSC形成突触样结构并通过去甲肾上腺素调节HFSC,而APM维持HFSC的交感神经。在没有去甲肾上腺素信号传导的情况下,HFSC通过下调细胞周期和代谢来上调静态调节因子Foxp1和Fgf18进入深度休眠。
在发育过程中,HFSC后代分泌SHH(Sonic Hedgehog)来指导这种APM交感神经微环境的形成,进而控制成年体内的毛囊再生。这些研究结果揭示了再生组织与其微环境在不同阶段之间的相互依赖关系,并证明了交感神经可以通过突触样连接和神经递质调节干细胞,从而使组织产生与需求耦合。
据了解,竖毛(鸡皮疙瘩)需要毛囊、立毛肌(APM)和交感神经的协同作用,这一现象为研究上皮、间充质和神经的相互作用提供了模型。
(评论:起鸡皮疙瘩竟然是身体在促进毛发生长的一种表现。)
文章来源:
Yulia Shwartz, Meryem Gonzalez-Celeiro et al, Cell Types Promoting Goosebumps Form a Niche to Regulate Hair Follicle Stem Cells. DOI: 10.1016/j.cell.2020.06.031 Cell:《细胞》最新IF:36.216
3、Nature:两个动态不同的回路驱动感觉丘脑抑制
2020年7月22日,来自Cruikshank研究组在在《自然》杂志上发表了题为“Two dynamically distinct circuits drive inhibition in the sensory thalamus.”的研究结果,发现两个动态不同的回路驱动感觉丘脑抑制。
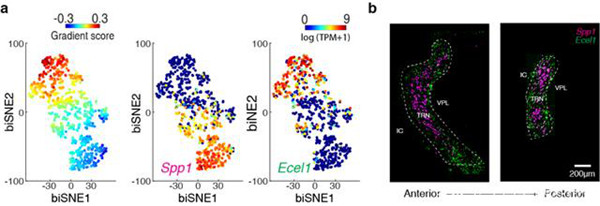
Fig 3 丘脑网状核神经元的分子异质性具有非常独特的特征(来源:Nature)
他们通过小鼠TRN的体感和视觉回路进行研究。在体感TRN中,他们观察到两组遗传上定义的神经元,它们在位置上是分离的并且在生理上是不同的,并且通过动态发散的突触,相互独立地连接着丘脑皮层核。表达Calbindin的细胞(位于中央核心)与腹侧后核(主要的体感丘脑皮质中继器)相连。相比之下,生长激素抑制素表达细胞(位于TRN的周围边缘)与后丘脑内侧核突触相连,后者是一个高层结构,既携带自上而下又自下而上的信息。
这两个TRN单元组以途径特定的方式处理其输入。从腹后核到中央TRN细胞的突触传递快速的兴奋性电流,该电流在重复性活动期间会严重降低,从而驱动相态峰值输出。从丘脑后内侧核到边缘TRN细胞的突触激活的速度较慢,抑制兴奋电流的程度较低,从而驱动了更持久的峰值。TRN细胞类型的内在生理学差异(包括依赖状态的爆发)有助于这些输出动态。
因此,这两个体感TRN子回路的处理专业化似乎已针对它们所携带的信号进行了调整——将主要的中央子电路调整为离散的感觉事件,将更高阶的边缘子电路调整为从多个源集成的时间分布信号。视觉TRN子回路的结构和功能与体感TRN的电路和结构极为相似。这些结果提供了对TRN神经元子网如何差异处理丘脑信息类别的见解。
据悉,到达新皮质的大多数感觉信息通过丘脑传递,在丘脑中发生相当大的转变。转换的一种方式涉及,将数据携带到皮层的兴奋性丘脑皮质神经元,与调节这些数据流的丘脑网状核(TRN)的抑制性神经元之间的相互作用。尽管人们早已认识到TRN的重要性,但对其细胞类型、组织和功能特性的了解却落后于对它们所控制的丘脑皮质系统。
(评论:首次从单细胞分子特性、神经元电生理特征、局部丘脑神经环路结构以及功能的角度为丘脑网状核绘制出了一幅综合图谱。)
文章来源:
Rosa I. Martinez-Garcia et al,Two dynamically distinct circuits drive inhibition in the sensory thalamus. DOI: 10.1038/s41586-020-2512-5 Nature:最新IF:43.07