1、Science:阿尔茨海默病致病机制解析!
近日,来自来自德国慕尼黑工业大学的研究人员在《Science》期刊上发表了标题为“A vicious cycle of β amyloid–dependent neuronal hyperactivation”的研究论,发现针对阿尔茨海默病首次能够解释这一早期重要的神经功能障碍的原因和机制。他们发现,兴奋性神经递质谷氨酸在活跃的神经元附近持续存在过长时间。这导致这些神经元遭受病理性过度刺激,这很可能是阿尔茨海默病患者学习和记忆丧失的关键因素。
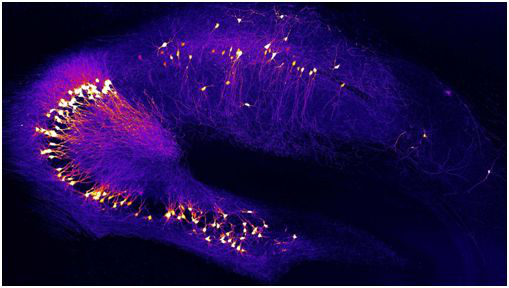
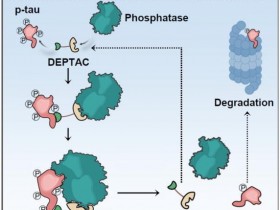
大脑海马体中的神经元在阿尔茨海默病的早期阶段就已受到损害
研究人员主要着重关注过度活跃的神经元,在这种疾病的较早阶段出现,由于过度活跃,神经回路中连接在一起的神经元不断地接收错误信号,从而导致信号处理受到损害。
高浓度的谷氨酸在高度活跃的神经元的突触间隙中持续存在过长时间。这是由于β-淀粉样蛋白分子的作用:它们阻止谷氨酸从突触间隙转运出来。他们使用来自患者样本的β-淀粉样蛋白分子并使用各种小鼠模型测试了这种机制,都获得了类似结果。
(评论:这一发现可能为新的治疗方法开辟道路。)
文章来源:
Benedikt Zott et al. A vicious cycle of β amyloid–dependent neuronal hyperactivation. Science, 2019, doi:10.1126/science.aay0198.
2、Science:揭秘肿瘤抑制蛋白TP53突变的显性负面效应
近日,来自美国和德国多个研究机构的科学家们在《Science》杂志上发表了题为“A dominant-negative effect drives selection of TP53 missense mutations in myeloid malignancies”的研究论文,揭示了TP53突变或具有显性的负面效应(dominant negative effect)。
研究人员描述了TP53基因突变的显性负面效应,这种效应会导致野生型TP53的活性下降,野生型的TP53即为天然非突变的TP53形式,这种显性负面效应是指当基因发生突变时,其会导致基因产物反向影响相同细胞中野生型的基因产物。
本文研究结果或能对科学家们长期以来的争论进行彻底地解释,即引发癌症的TP53突变或会改变野生型TP53的功能,为了回答这一问题,研究人员利用CRISPR/Cas9制造出了多种的人类白血病细胞,其通常能够代表参与白血病发生的常见突变类型,而这些白血病细胞也能被用来研究肿瘤的进展。在观察突变发生的过程中,研究人员并未发现,错义点突变会为TP53抑制性蛋白添加新的功能,相反,本文研究却发现,基因的突变会减少蛋白质的功能或产生显性负面效应,从而引发肿瘤抑制效率的下降。
(评论:这种显性负效应可以推动癌前病变细胞进化,对癌细胞的形成有重要作用。)
文章来源:
Steffen Boettcher, Peter G. Miller, Rohan Sharma, et al. A dominant-negative effect drives selection of TP53 missense mutations in myeloid malignancies, Science (2019). DOI: 10.1126/science.aax3649.
3、Science Translational Medicine:duoCAR-T细胞在确保不被HIV感染的同时高效抑制HIV
近日,来自美国研究公司和各大学等研究人员在《Science Translational Medicine》期刊上发表了题为“Multispecific anti-HIV duoCAR-T cells display broad in vitro antiviral activity and potent in vivo elimination of HIV-infected cells in a humanized mouse model”的研究结果,描述了如何构建duoCAR-T细胞以及它们如何很好地在人源化小鼠模型中发挥作用。
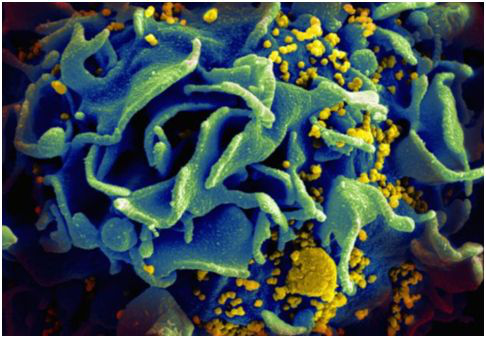
图 | 受HIV感染的T细胞的扫描电镜图
研究人员采用了一种更新的方法来使用CAR-T细胞来对抗HIV,让它们的CAR分子加倍。由此所获得的细胞被命名为duoCAR-T细胞。这种新方法的优势在于它靶向HIV包膜上的多个位点,而不是让T细胞发生改变后以CD4受体作为靶向位点。所使用的这两种特定的CAR分子是在开发40多种慢病毒载体并测试它们以观察哪种慢病毒载体是最有效的过程中发现的。
在实验室测试时, duoCAR-T细胞消除了大约99%的受感染的免疫细胞品系。当在人类小鼠模型上进行测试时,duoCAR-T细胞的剂量在治疗仅一周后能够抑制97%的HIV感染---远远优于传统的CAR-T细胞。duoCAR-T细胞经证实对HIV感染有抵抗力,这就克服了传统使用CAR-T细胞治疗HIV患者所面临的一个主要问题。最后,旨在测试这种新方法的有效性和安全性的临床试验计划最早在明年春天开始。
(评论:可清除体内97%受感染细胞,太厉害了。)
文章来源:
Kim Anthony-Gonda et al. Multispecific anti-HIV duoCAR-T cells display broad in vitro antiviral activity and potent in vivo elimination of HIV-infected cells in a humanized mouse model. Science Translational Medicine, 2019, doi:10.1126/scitranslmed.aav5685.