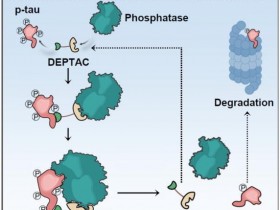
2024年6月7日,来自清华大学施一公等研究人员合作在学术期刊《科学》上发表了标题为“Molecular mechanism of substrate recognition and cleavage by human γ-secretase.”的研究成果,揭示出人类γ-分泌酶识别和切割底物的分子机制。
阿尔茨海默病(AD)的标志性特征是淀粉样斑块沉积,主要由γ-分泌酶从99个氨基酸残基的淀粉样前体蛋白C末端片段(APP-C99)切割产生的β-淀粉样蛋白(Aβ)肽组成。γ-分泌酶对APP-C99连续切割并产生了不同长度的β-淀粉样蛋白(Aβ)肽,值得注意的是,通常每次切割3个氨基酸残基,然而,这种连续切割以及每次切割3个氨基酸残基的具体机制目前仍不清楚。
成熟的γ-分泌酶由四个亚基组成,分别是前体蛋白酶(PS)、前体蛋白酶增强因子2(PEN-2)、前咽缺陷蛋白1(APH-1)和Nicastrin蛋白(NCT)。其中催化亚基是PS,而PS1是其主要的异构体。人γ-分泌酶与APP-C83结合的冷冻电镜(cryo-EM)结构揭示了底物和PS1之间的杂交β-折叠,底物β链引导切割位点,与APP-C83相比,由γ-分泌酶切割的APP-C99效率较低。APP-C99的N端多出的16个氨基酸可能调节γ-分泌酶-底物复合物的形成。
尽管已经在γ-分泌酶结构上取得了进展,但控制其连续切割的底层机制仍不清楚,特别是不清楚为什么切割过程中主要每次切割三个氨基酸残基。
研究人员表示,γ-分泌酶连续切割淀粉样前体蛋白C端99个残基的片段(APP-C99),产生了不同长度的淀粉样-β(Aβ)肽。大多数切割的步长为三个残基。
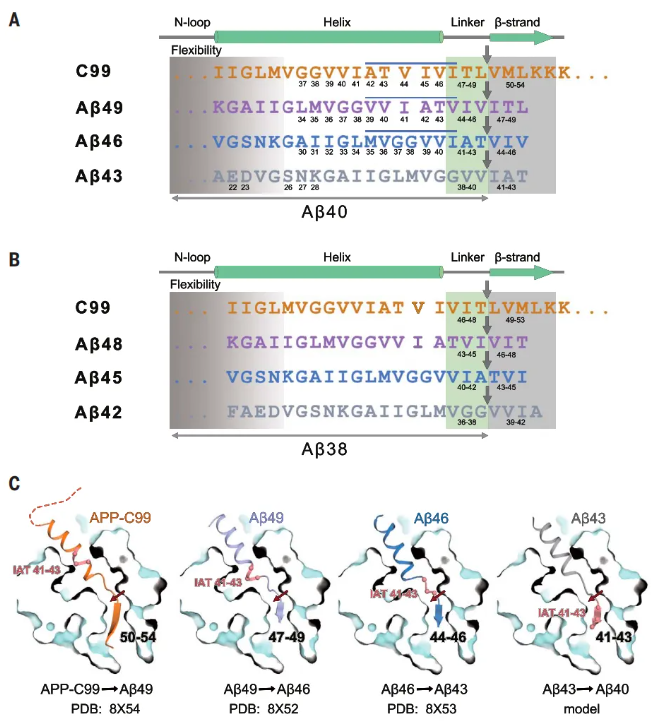
人γ-分泌酶裂解底物的机制
为了阐明其基本机制,研究人员测定了单独与APP-C99、Aβ49、Aβ46和Aβ43结合的人类γ-分泌酶的原子结构。在所有情况下,底物都显示出相同的结构特征:跨膜α-螺旋、三位残基连接体和β-链,β-链与早老素1(PS1)形成混合β-片。蛋白水解发生在底物β链的前端。每次切割后,底物α-螺旋都会松开并平移一圈,形成新的β-链。这一机制与现有的生化数据一致,并可解释γ-分泌酶对其他底物的切割。
该研究确定了人γ-分泌酶分别与APP-C99、Aβ49、Aβ46和Aβ43结合的原子分辨率的冷冻电镜(cryo-EM)结构,描述了人类γ-分泌酶在淀粉样前体蛋白(APP)切割过程中如何与不同的Aβ肽底物相互作用,阐明了γ-分泌酶如何产生不同长度的Aβ肽,这些发现将加深我们对淀粉样蛋白生物学的理解,并有助于开发治疗阿尔茨海默病的策略。
文章来源:
Xuefei Guo, Haotian Li, Chuangye Yan et al,Molecular mechanism of substrate recognition and cleavage by human γ-secretase.DOI: adn5820,Science:最新IF:63.714