2020年9月10日,来自美国加州大学洛杉矶分校(UCLA)琼森综合癌症中心Antoni Ribas和Catherine S. 《癌细胞》杂志上发表标题为“ Conserved Interferon-γ Signaling Drives Clinical Response to Immune Checkpoint Blockade Therapy in Melanoma.”的研究成果,他们的最新研究提出保守的干扰素-γ(IFN-γ)信号驱动免疫检查点封锁治疗黑色素瘤的临床反应。
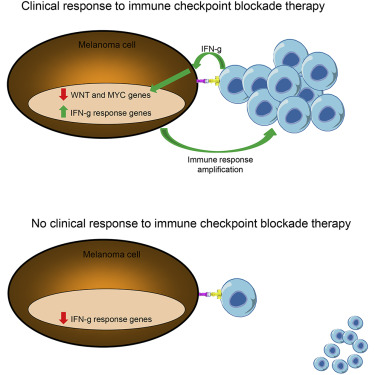
Fig 1 | 来源Cancer Cell
他们分析了101例单独用nivolumab(抗PD-1)或与ipilimumab(抗CTLA-4)联合治疗的晚期黑色素瘤患者的基线和治疗中肿瘤活检的转录组。他们发现,T细胞浸润和IFN-γ信号特征与临床上治疗的反应高度一致,而在相应的活检样品中细胞周期和WNT信号传导途径则相应减少。
他们对58种人类细胞系中的相互作用进行建模,发现除非细胞IFN-γ受体改变,否则IFN-γ的体外暴露会导致保守的转录组反应。黑色素瘤细胞中这种保守的IFN-γ转录组反应可放大抗肿瘤免疫反应。因此,抗肿瘤T细胞反应的强度和相应的下游IFN-γ信号传导是临床反应或对免疫检查点封锁疗法耐药的主要驱动力。
(评论:一种新方法来预测患者对免疫疗法所产生的反应。)
文章来源:
Catherine S. Grasso, Jennifer Tsoi et al, Conserved Interferon-γ Signaling Drives Clinical Response to Immune Checkpoint Blockade Therapy in Melanoma. DOI: 10.1016/j.ccell.2020.08.005. Cancer Cell:最新IF:23.916
2、Cell Metabolism:温度可改善肠道微生物来增强骨骼强度
2020年9月10日,来自瑞士日内瓦大学Mirko Trajkovski课题组发现在《细胞—代谢》上发表了题为“Warmth Prevents Bone Loss Through the Gut Microbiota.”的研究成果,研究发现温暖的温度,能够通过影响菌群,来阻止骨质流失。
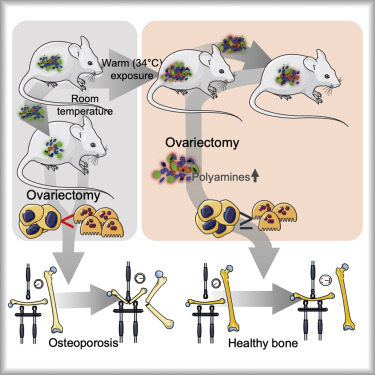
Fig 2| 来源:Cell Metabolism
研究人员表明,温暖(34°C)通过增加小梁骨的体积、连接密度和厚度来防止卵巢切除术引起的骨质流失,从而提高成年雌性以及年轻雄性小鼠的生物力学骨强度。温暖适应型微生物群的表型复制了温暖引起的骨骼效应。温暖和温暖型微生物群移植均可逆转卵巢切除术引起的胫骨转录组学变化,并增加骨膜骨的形成。
组合宏基因组学/代谢组学分析表明,温度增强细菌多胺的生物合成,导致体内总多胺水平更高。补充精胺和亚精胺可增强骨骼强度,而在体内抑制多胺生物合成限制了对骨骼有益的保暖作用。这些数据表明,温热暴露可作为骨质疏松症的潜在治疗选择,同时为其在骨病中的益处提供机制。
据介绍,骨质疏松症是最普遍的代谢性骨疾病,其特征是骨量低和微结构恶化。
(评论:那最有效的办法是运动来提升温度,对增强骨骼力量有很大的帮助是有原因的。)
文章来源:
Claire Chevalier, Silas Kieser et al, Warmth Prevents Bone Loss Through the Gut Microbiota. DOI: 10.1016/j.cmet.2020.08.012. Cell Metabolism, 最新IF:22.415
3、Cell Metabolism:谷氨酸代谢能调控毛囊干细胞
2020年9月8日,来自德国科隆大学Sara A. Wickström、Sabine A. Eming等研究人员合作在《细胞—代谢》杂志在线发表了题为“Glutamine Metabolism Controls Stem Cell Fate Reversibility and Long-Term Maintenance in the Hair Follicle.”的研究成果,发现谷氨酰胺代谢调控毛囊干细胞的命运可逆性和长期维持。
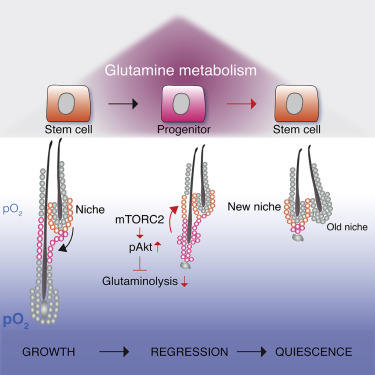
Fig 3 | 来源:Cell Metabolism
研究人员表示,干细胞位于对其功能至关重要的特殊微环境中。当激活后,毛囊干细胞(HFSC)退出其微环境,进而产生外根鞘(ORS),但是ORS子代中一类细胞又会返回到这个微环境中,并恢复SC状态。这种细胞命运可逆性的机制尚不清楚。
研究人员发现,ORS细胞返回SC状态需要抑制从糖酵解到氧化磷酸化和谷氨酰胺代谢的新陈代谢转换,这一转换发生在早期HFSC谱系进展中。HFSC的命运可逆性和谷氨酰胺代谢受微环境内mTORC2-Akt信号轴的调控。敲除mTORC2能够导致HFSC微环境重建的失败、毛囊再生不良以及HFSC长期维护的损害。
(评论:这些发现强调了器官稳态中SC代谢状态时空性调控的重要性。)
文章来源:
Christine S. Kim, Xiaolei Ding et al, Glutamine Metabolism Controls Stem Cell Fate Reversibility and Long-Term Maintenance in the Hair Follicle. DOI: 10.1016/j.cmet.2020.08.011, Cell Metabolism 最新IF:22.415