1、Science:耶尔森菌感染并触发细胞焦亡的关键因子——Rag-Ragulator复合物
2021年6月25日,来自中国科学院上海巴斯德研究所刘星、美国哈佛医学院Judy Lieberman等研究人员合作在发表了题为“The lysosomal Rag-Ragulator complex licenses RIPK1– and caspase-8–mediated pyroptosis by Yersinia.”的研究论文,发现溶酶体Rag-Ragulator复合物调控RIPK1和caspase-8介导的细胞焦亡。
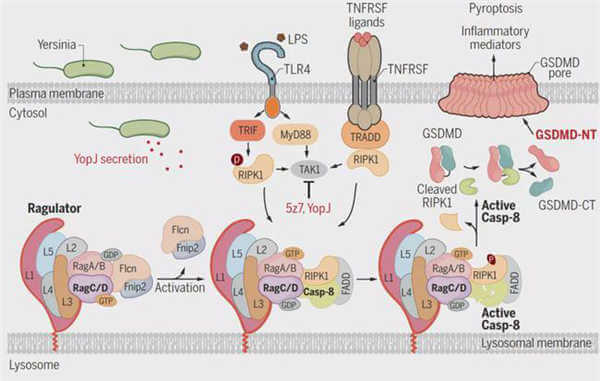
2018年,马萨诸塞医学院Egil Lien和塔夫茨医学院Alexander Poltorak课题组相继发现耶尔森菌分泌的毒力蛋白YopJ通过抑制TAK1激活RIPK1/caspase-8,从而进一步切割GSDMD导致焦亡,但抑制后的TAK1如何激活RIPK1/caspase-8的分子机制尚不清晰。
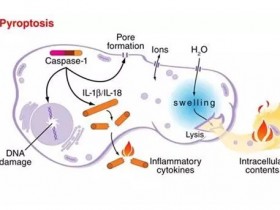
研究人员表示,宿主细胞启动细胞死亡程序来限制病原体感染。巨噬细胞中致病性耶尔森菌对转化生长因子-β-活化激酶1(TAK1)的抑制能够触发受体相互作用的丝氨酸-苏氨酸蛋白激酶1(RIPK1)-依赖的caspase-8切割gasdermin D(GSDMD)和炎症细胞死亡(细胞焦亡)。
通过caspase-8依赖性细胞焦亡介导因子的全基因组CRISPR筛选,研究人员确定了溶酶体卵泡素(FLCN)-卵泡素相互作用蛋白2(FNIP2)-Rag-Ragulator超级复合物的意外作用,该复合物可调节代谢信号和哺乳动物雷帕霉素靶蛋白复合物1(mTORC1)。
为了响应耶尔森氏菌感染,Fas相关死亡域(FADD)、RIPK1和caspase-8被招募到 Rag-Ragulator,导致RIPK1磷酸化和caspase-8激活。焦亡激活取决于Rag鸟苷三磷酸酶活性和Rag-Ragulator的溶酶体束缚,而不是mTORC1。因此,溶酶体代谢调节因子Rag-Ragulator指导对耶尔森菌的炎症反应。
(评论:详细解析了耶尔森菌感染后宿主细胞内RIPK1/caspase-8活化分子机制,是对细胞焦亡领域一大拓展,也为如鼠疫耶尔森菌和肠炎耶尔森菌感染相关疾病治疗提供了新靶点和新思路。)
文章来源:
Zengzhang Zheng, Wanyan Deng et al, The lysosomal Rag-Ragulator complex licenses RIPK1– and caspase-8–mediated pyroptosis by Yersinia. DOI: 10.1126/science.abg0269, Science, 最新IF:41.037
2、Nature Biotechnology:魏文胜课题组开发出基于碱基编辑的新型高通量功能性筛选方法
2021年6月21日,来自北京大学魏文胜课题组在《自然—生物技术》发表了题为“Genome-wide interrogation of gene functions through base editor screens empowered by barcoded sgRNAs”的研究成果,开发出基于碱基编辑的新型高通量功能性筛选方法
研究人员表示,经典CRISPR基因敲除(KO)筛选依赖于Cas9引起的DNA双链断裂(DSB)来生成靶向基因KO。这些方法可能会产生扭曲的结果,因为DSB相关效应通常被错误地认为是基因扰动本身的后果,尤其是当靶向高拷贝数位点时。
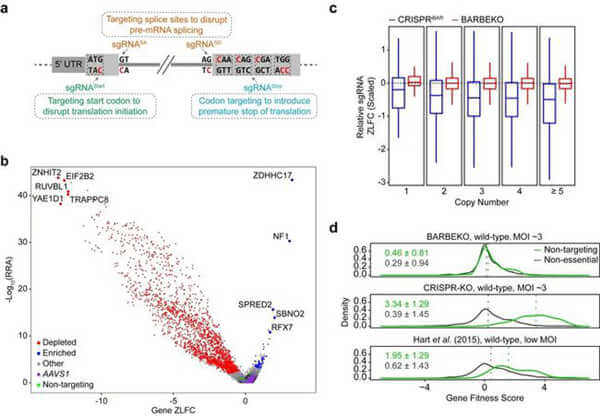
研究人员报告了一种不依赖于DSB的全基因组CRISPR筛选方法,称为iBARed胞嘧啶碱基编辑介导的基因KO(BARBEKO)。通过扰乱基因起始密码子或剪接位点,或通过引入过早终止密码子,该方法利用CRISPR胞嘧啶碱基编辑器进行基因组规模的KO筛选。此外,它与iBAR集成,这是研究人员为提高筛选质量和效率而设计的策略。通过以高感染多样性(最多10个)慢病毒感染构建这样的细胞文库,研究人员获得了有效且准确的筛选结果,同时大大减少了起始细胞。
更重要的是,与Cas9介导的筛选相比,BARBEKO筛选不再受HeLa、K562或DSB敏感的视网膜色素上皮1细胞中DNA断裂诱导的细胞毒性影响。研究人员认为,BARBEKO会提供一种有价值的工具来补充各种条件下的CRISPR-KO筛选。
(评论:BARBEKO方法为原代细胞、类器官或模式动物体内等复杂生物模型的高通量筛选提供了更优的选择;为数量受限的细胞样品(如病人来源的细胞)提供了高效筛选方案,因此是基因功能和临床前研究的有力工具。)
文章来源:
Ping Xu, Zhiheng Liu, Genome-wide interrogation of gene functions through base editor screens empowered by barcoded sgRNAs。DOI: 10.1038/s41587-021-00944-1. 最新IF:31.864
2021年6月23日,来自日本东京医科牙科大学西村荣美研究团队在《自然》杂志上发表了题为“Obesity accelerates hair thinning by stem cell-centric converging mechanisms.”的研究论文,揭示肥胖通过以干细胞为中心的收敛机制加速脱发。
肥胖是一种全球流行病,它使个体易患许多与年龄相关的疾病,但它对器官功能障碍的确切影响在很大程度上是未知的。毛囊——生长毛发的微型上皮器官——随着年龄的增长而缩小,通过耗尽HFSC导致脱发。
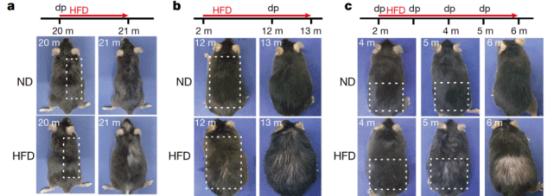
他们报告肥胖引起的压力,例如由高脂肪饮食 (HFD) 引起的压力,靶向毛囊干细胞 (HFSC)来加速脱发。按时间顺序排列的基因表达分析显示,在年轻小鼠中连续四天喂食 HFD,通过产生过量的活性氧将活化的 HFSCs 导向表皮角化,但不会减少 HFSCs 的数量。使用干细胞命运追踪、表观遗传学和反向遗传学的综合分析表明,进一步喂食 HFD 随后通过自分泌和/或旁分泌 IL-1R 信号诱导 HFSC 内的脂滴和 NF-κB 活化。
这些综合因素集中在 HFSC 中 Sonic Hedgehog (SHH) 信号转导的显著抑制上,从而通过其异常分化进一步消耗富含脂质的 HFSC,并诱导毛囊小型化和最终脱发。相反,SHH 的转基因或药理学激活挽救了 HFD 诱导的脱发。这些数据共同表明,肥胖诱导的干细胞炎症信号强烈抑制器官再生信号以加速微型器官的小型化,并表明日常预防器官功能障碍的重要性。
(评论:首次在机制层面深入解读了肥胖与脱发之间的联系,并发现了毛囊干细胞与 SHH 通路在这个过程中的关键作用。尽管小鼠模型与人类的脱发之间存在一定的差异,该研究的表型足够强大,也足以让人们采取健康的生活方式以控制体重,来达到缓解脱发的目的。)
文章来源:
Hironobu Morinaga, Yasuaki Mohri et al, Obesity accelerates hair thinning by stem cell-centric converging mechanisms. DOI: 10.1038/s41586-021-03624-x, Nature:最新IF:43.07