1、Nature:邵峰/刘小云新发现-新的机制来逃避细胞焦亡
2021年10月20日,来自北京生命科学研究所邵峰、北京大学刘小云等研究人员合作在学术期刊《自然》发表了题为“ Shigella evades pyroptosis by arginine ADP-riboxanation of caspase-11.”得研究结果,发现,志贺氏菌通过caspase-11的精氨酸ADP-riboxanation来逃避焦亡。
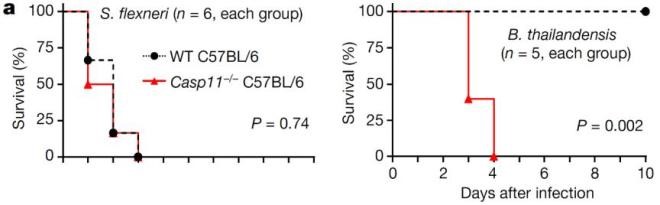
Fig 1:(左:感染志贺菌;右:感染伯克霍尔德菌)来源nature
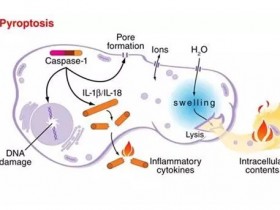
研究人员表示,小鼠的caspase-11和人类的caspase-4和caspase-5识别细胞膜脂多糖(LPS),通过切割成孔蛋白GSDMD来诱导焦亡。这种非经典的炎症体能抵御革兰氏阴性细菌。导致细菌性痢疾的福氏志贺氏菌自由地生活在宿主的细胞膜内,这些caspase就驻扎在那里。然而,caspase-11介导的焦亡在福氏志贺氏菌感染中的作用尚不清楚。
研究人员发现,caspase-11不能保护小鼠免受福氏志贺氏菌感染,这与另一种细胞型细菌Burkholderia thailandensis的感染相反。福氏志贺氏菌利用III型分泌系统(T3SS)效应蛋白OspC3逃避了由caspase-11或caspase 4(以下简称caspase-11/4)介导的焦亡。OspC3,但不是其类似物OspC1和2,共价修饰caspase-11/4;尽管它使用了NAD+供体,但这种修饰不是ADP-核糖基化。
生物化学分析发现,在caspase-4和caspase-11中的Arg314和Arg310分别有ADP-riboxanation修饰。OspC1和2也有这种酶活性,它们的蛋白重复域与OspC3不同,不能识别caspase-11/4。精氨酸的ADP-riboxanation阻断了caspase-4/11的自加工,以及它们对GSDMD的识别和切割。caspase-11的ADP-riboxanation破坏了志贺氏菌感染小鼠中焦亡介导的防御,OspC3的突变刺激了caspase-11和GSDMD依赖的抗志贺氏菌体液免疫,产生了类似疫苗的保护效果。这项研究表明,精氨酸的ADP-riboxanation是一种细菌毒力机制,可以防止LPS诱导的焦亡。
(评论:这不同于已知的自我改变或间接的细菌炎症小体调节策略,例如耶尔森氏菌 YopM23 对 Pyrin 炎症小体的抑制。未来的研究将发现其他炎症小体/细胞焦亡靶向效应物。)
文章来源:
Li, Zilin, Liu, Wang, Fu, Jiaqi et al, Shigella evades pyroptosis by arginine ADP-riboxanation of caspase-11. DOI: 10.1038/s41586-021-04020-1, 最新IF:43.07
2、Cell:绘制DNA 双链断裂 (DSB)修复的遗传图谱
2021年10月20日,来自美国普林斯顿大学Britt Adamson和加州大学Jonathan S. Weissman研究组合作在学术期刊《细胞》杂志上发表了标题为“Mapping the genetic landscape of DNA double-strand break repair.”得研究结果,绘制DNA 双链断裂 (DSB)修复的遗传图谱。
为了系统地绘制这些通路,他们开发了一种称为 Repair-seq 的高通量筛选方法,该方法可以测量数千种遗传扰动对在目标 DNA 损伤处引入突变的影响。使用 Repair-seq,他们分析了在存在或不存在用于同源定向修复 (HDR) 的寡核苷酸的情况下,在敲除参与 DSB 修复或相关过程的 476 个基因后,由两种可编程核酸酶(Cas9 和 Cas12a)诱导的 DSB 修复产物。由此产生的数据支持对 DSB 末端连接和 HDR 路径进行有原则的、数据驱动的推理。
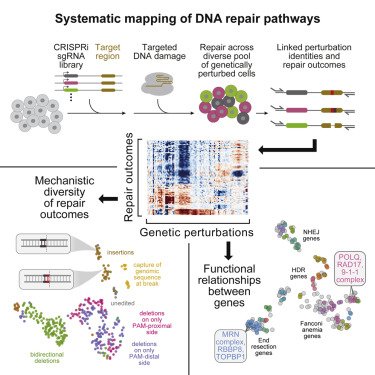
Fig 2来源cell
对这些数据的系统询问揭示了 DSB 修复基因之间意外关系,并证明了具有表面相似序列结构的修复结果可能具有明显不同的遗传依赖性。这项工作为绘制 DNA 修复途径和优化跨不同模式的基因组编辑奠定了基础。
据介绍,细胞通过一系列对维持基因组完整性至关重要的复杂途径修复DSB。
(评论:具体图谱已经发布,大家可以去查看这些途径,看看双链断裂修复涉及的巨大复杂性和无数系统)
文章来源:
Jeffrey A. Hussmann, Jia Ling et al, Mapping the genetic landscape of DNA double-strand break repair. DOI: 10.1016/j.cell.2021.10.002, 最新IF:36.216
2021年10月20日,来自美国麻省理工学院Matthew G. Vander Heiden课题组合作在学术期刊《自然》发表了题为“Low glycaemic diets alter lipid metabolism to influence tumour growth.”的研究成果,发现低血糖饮食改变脂质代谢来影响肿瘤的生长。
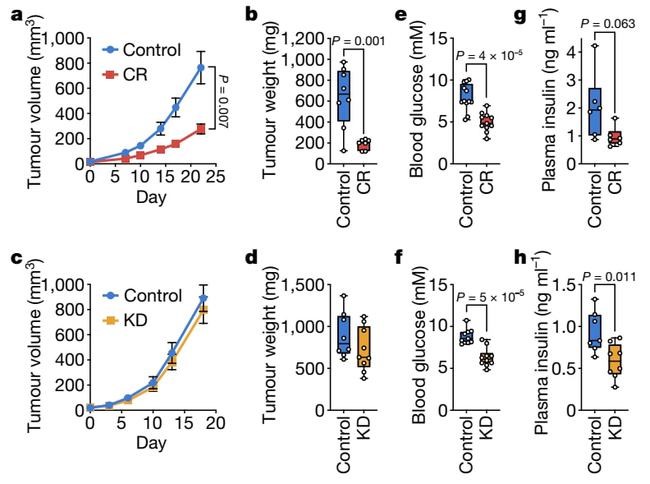
Fig 3 |CR,而不是KD,会损害胰腺导管腺癌同种异体移植肿瘤的生长(来源nature)
虽然热量限制(CR)和生酮饮食(KD)通常被认为是通过降低血糖和胰岛素水平来限制肿瘤的发展,但研究人员发现只有CR能抑制小鼠体内特定肿瘤移植体的生长,这表明其他机制有助于抑制肿瘤的生长。CR中观察到的营养供应变化是血浆和肿瘤中的脂质水平降低。合成单不饱和脂肪酸的硬脂酰-CoA去饱和酶(SCD)的上调是癌细胞在脂质耗尽的环境中增殖所必需的,CR也会损害肿瘤SCD的活性,导致不饱和脂肪酸和饱和脂肪酸之间的不平衡,从而减缓肿瘤的生长。通过较高脂肪的CR饮食,强制癌细胞SCD的表达或提高循环脂质水平,使其对CR的影响产生抵抗。
相比之下,尽管KD也损害了肿瘤SCD的活性,但KD驱动的脂质供应增加维持了肿瘤中不饱和脂肪酸的比例,并且改变KD脂肪组成来提高肿瘤饱和脂肪酸水平能够与降低肿瘤SCD的活性共同来减缓肿瘤生长速度。这些数据表明,饮食引起的肿瘤脂肪酸去饱和化活性和特定脂肪酸种类可用性之间的不匹配决定了低血糖饮食是否会损害肿瘤生长。
据悉,饮食干预可以改变肿瘤微环境中的代谢物水平,进而影响癌细胞的代谢,改变肿瘤的生长。
(评论:研究表明饮食可以改变肿瘤代谢物的利用率,影响癌细胞的代谢,从而影响生长。更好地理解饮食对肿瘤代谢和进展的影响可能导致采用正交策略来模拟特定饮食的影响,并为如何结合饮食干预来改善癌症患者的护理提供指导。)
文章来源:
Lien, Evan C., Westermark et al, Low glycaemic diets alter lipid metabolism to influence tumour growth,DOI: 10.1038/s41586-021-04049-2,Nature:最新IF:43.07