1、Science Advances:新型数字PCR技术可在3小时内测定“端粒”单分子绝对长度
2020年8月21日,来自新加坡国立大学的研究人员在《Science Advances》杂志上发表了题为“Massively parallel single-molecule telomere length measurement with digital real-time PCR”的研究结果,他们设计了一种名为单端粒绝对长度快速分析(STAR)的新方法,能够快速测量端粒的绝对长度。他们报告称,该方法准确灵敏,并且能够测定癌细胞中的染色体外端粒重复序列(ECTR)。
此次开发的STAR方法是利用数字PCR技术对样本进行分液,然后在纳升级区室内测定端粒重复序列的长度。在此过程中,他们采用Fluidigm的48.770数字芯片和Biomark HD系统(48.770代表可运行48个样本,每个样本分成770小份进行数字PCR分析)。
PCR扩增导致PCR产物的增加与端粒重复片段的初始长度或拷贝数成正比。PCR产物的增加体现在荧光强度的变化中。通过对荧光信号的实时监测,研究人员可捕获产物变化。
此外,他们还用EvaGreen染料来取代经典的SYBR Green I染料,并对退火温度和引物浓度进行了调整。同时,为了测定端粒的绝对长度,他们利用已知长度的合成端粒生成了标准曲线,并根据该标准曲线来计算其他端粒的长度。
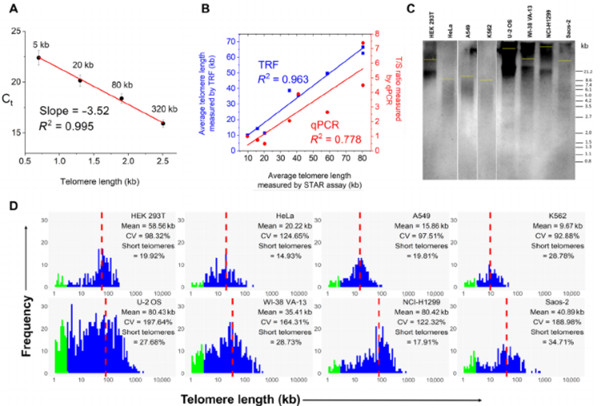
Fig 1. STAR assay allows single molecule telomere length measurement
研究人员利用一组癌细胞验证了STAR分析,并与TRF和其他方法的结果进行了对比。他们报告称,通过STAR分析测得的端粒平均长度与金标准的TRF方法高度相关,这表明STAR分析是测量端粒绝对长度的可靠方法。而且,处理时间减少了三个小时。
之后,他们又利用STAR分析来定量染色体外端粒重复序列,这是癌细胞的一种特征,它利用同源重组机制来维持其端粒。他们对四个儿科的成神经细胞瘤样本进行了分析,发现两个样本呈阳性,两个样本呈阴性,与其他研究的结果一致。这表明肿瘤实验室可采用STAR分析来确定端粒的维持机制。
(评论:哇塞~ 3小时内测量多达48个样品的单个端粒的绝对端粒长度,这效率和准确度真的可以帮助到端粒长度异常与许多衰老相关疾病预防和治疗。)
文章来源:
Yongqiang Luo,Ramya Viswanathan et al.Massively parallel single-molecule telomere length measurement with digital real-time PCR. DOI: 10.1126/sciadv.abb7944
2、Nature Immunology:PD-1阻断疗法的临床疗效可被预测
2020年8月31日,来自日本名古屋大学医学研究科免疫学系Hiroyoshi Nishikawa研究组在《自然-免疫学》杂志上发表了题为“The PD-1 expression balance between effector and regulatory T cells predicts the clinical efficacy of PD-1 blockade therapies.”研究成果。他们的研究认为效应性和调节性T(Treg)T细胞之间的程序性细胞死亡蛋白1(PD-1)表达平衡可预测PD-1阻断疗法的临床疗效。
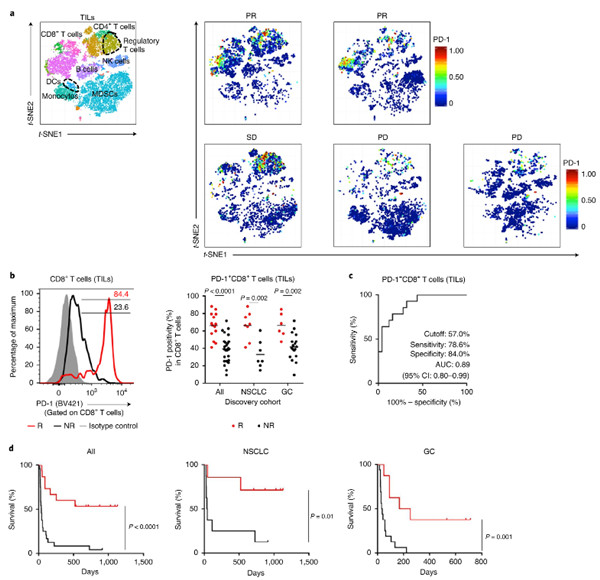
Fig 2. Responders to PD-1 blockade therapies have high PD-1+CD8+ Tcell infiltration in the TME
他们显示肿瘤微环境中PD-1 + CD8 + T细胞相对于PD-1 + Treg细胞的频率可以预测PD-1阻断的临床疗效,并且优于其他预测因子,包括PD配体1(PD-L1)表达或肿瘤突变负荷。CD8 + T细胞和Treg细胞的PD-1表达分别对效应性和免疫抑制功能产生进行负向调控。PD-1阻滞既可导致功能障碍的PD-1 + CD8 + T细胞恢复,又可增强PD-1 + Treg细胞介导的免疫抑制作用。
通过阻断PD-1,效应性PD-1 + CD8 + T细胞而不是PD-1 + Treg细胞的彻底重新激活对于肿瘤消除是必要的。这些发现为PD-1阻断疗法提供了有望的预测性生物标志物。
(评论:据了解,免疫检查点封锁已在癌症治疗中提供了范式转变,但是这种方法的成功因素是非常可变的。因此,迫切需要可预测临床疗效的生物标志物。)
文章来源:
Shogo Kumagai, Yosuke Togashi et al, The PD-1 expression balance between effector and regulatory T cells predicts the clinical efficacy of PD-1 blockade therapies. DOI: 10.1038/s41590-020-0769-3. Nature Immunology:最新IF:23.53
3、Science:中国科学家发现谷氨酸能神经元对睡眠稳态调节的重要作用
2020年9月4日,来自北京大学麦戈文脑科学研究所李毓龙研究组合在《Science》杂志发表了题为“Regulation of sleep homeostasis mediator adenosine by basal forebrain glutamatergic neurons.”的研究论文,该项研究利用新型遗传编码的腺苷探针,发现基底前脑区的谷氨酸能神经元对于睡眠压力的积累起着重要的调控作用,进一步揭示了睡眠稳态调控的神经环路机制。
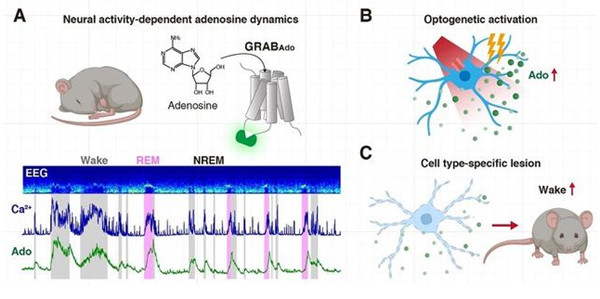
Fig 3 ,腺苷快速释放和睡眠稳态的神经调控。
目前,主流理论认为“腺苷”参与到睡眠稳态调节过程中,其在清醒状态下的积累导致了“困意”的产生,而咖啡的主要成分咖啡因可以通过阻断腺苷与其受体的结合而达到促进清醒的效果。基底前脑被认为是腺苷参与睡眠稳态调控的重要脑区,环路层面的研究表明,该区域的局部神经环路参与到对睡眠觉醒的调控中,然而神经元活动调控腺苷释放的机制目前还不清楚。这限制了人们对睡眠觉醒调控机制的深入解析。
为了实现在睡眠觉醒周期中对基底前脑区胞外腺苷浓度高时空分辨率的检测,李毓龙研究组开发了一种新型的遗传编码的腺苷探针,该探针可以将胞外腺苷浓度的变化转化为探针荧光强度的快速变化。
利用该腺苷探针,徐敏研究组发现基底前脑区的腺苷浓度在清醒状态时较高,在非快速眼动睡眠时较低,这与之前采用微透析法测量腺苷浓度变化的研究结果相一致。然而,小鼠的快速眼动睡眠时长较短,传统的微透析方法无法对快速眼动睡眠时期的腺苷浓度进行精确测量。得益于该探针的高时间分辨率,徐敏研究组首次发现,腺苷在快速眼动睡眠时期也存在很高的浓度,并且高于清醒和非快速眼动睡眠状态。不仅如此,研究者观察到,腺苷浓度在睡眠时相转变时存在快速的变化,提示其与神经元的活动密切相关。
为了进一步探究腺苷浓度增加与神经元活动的关系,徐敏研究组探究了基底前脑区两类神经元:乙酰胆碱能神经元和谷氨酸能神经元与腺苷浓度变化的相关性和因果性。结果表明这两类神经元的钙活动与胞外腺苷浓度高度相关,并且神经活动总是提前于腺苷释放。光遗传激活这两类神经元能引起胞外腺苷浓度不同程度的增加,而谷氨酸能神经元的激活是腺苷浓度增加的主要原因。进一步,研究人员特异性损毁基底前脑区的谷氨酸能神经元,结果表明,胞外腺苷浓度的增加显著低于对照组小鼠。以上试验表明,谷氨酸能神经元的活动参与调控胞外腺苷积累过程。
(评论:这为为探索睡眠障碍的治疗方法提供了重要参考。)
文章来源:
Wanling Peng,Zhaofa Wu et al. Regulation of sleep homeostasis mediator adenosine by basal forebrain glutamatergic neurons. DOI: 10.1126/science.abb0556 Science:最新IF:41.037