
主持人艾豆:大家好,欢迎收看大型生物科普类栏目——《我艾看生物》,我是主持人艾豆。前段时间我们收到这样一条投稿,说是T细胞会 “衰老”。不是吧,不是吧,T细胞竟然也会“衰老”?让我们连线前方记者,一探究竟。
小艾:好的主持人,我是小艾,我现在和当事人在一起,我的左边是清华大学廖学斌课题组与中山大学魏来课题组的成员们,右边这位就是今天话题的主人公T细胞。
小艾:请问作为当事人,就近期有关于你会“衰老”的事件,T细胞,您怎么看?
T细胞:不是吧,阿Sir,会“衰老”犯法啊,对我又研究,又发文,现在还要采访报道。
小艾:别激动,兄弟,我们是科普类栏目,主要是向大家传播有关于你的知识。
T细胞:好吧,那我简单介绍下自己。我——T淋巴细胞(T lymphocyte)——简称T细胞,是由来源于骨髓的淋巴干细胞,在胸腺中分化、发育成熟后,通过淋巴和血液循环而分布到全身的免疫器官和组织中发挥免疫功能 。内源性或转移的细胞毒性T细胞是抗肿瘤免疫的基本介质,持续的抗原暴露当然会使我逐渐变成衰竭状态,你们真的是大惊小怪。
小艾:那各位科学家,对于T细胞的说法有什么要解释的吗?
科学家:目前免疫肿瘤学中最紧迫的问题之一就是如何防止T细胞衰竭,从而扩展其功能,我们这么做只是为了帮助T先生。
我们发现造血祖细胞激酶1(HPK1)既是一种免疫抑制调节激酶,也是一种T细胞受体(TCR)的负调节因子,会破坏TCR信号复合体的稳定性。先前的研究表明,HPK1激酶可以抑制多种细胞的免疫功能,而灭活其结构域足以引发抗肿瘤免疫反应效应。这表明,HPK1是一个很有前途的肿瘤免疫治疗的候选靶点。于是,2020年8月28日,由清华大学廖学斌课题组与中山大学魏来课题组合作, 揭示了HPK1介导T细胞功能障碍,并且是T细胞免疫疗法的药物靶标。相关成果发表在《Cancer cell》上。

在之前的研究中,研究人员已经证实,在25种不同类型癌症的肿瘤浸润性T细胞中,抑制性PDCD1(编码PD-1)受体和MAP4K1(编码HPK1)之间存在强烈的正相关关系。现通过进一步的检测MAP4K1与肿瘤浸润性T细胞中的其他抑制性受体的相关性发现,不同癌症患者的MAP4K1与T细胞衰竭信号(CD3E、TIGIT、PDCD1、CTLA4、HAVCR2和LAG3)呈正相关,而检测患者肿瘤标本中抑制受体和HPK1的蛋白表达时也发现衰竭T细胞中HPK1表达上调。这些结果证实了HPK1与肿瘤浸润性T细胞耗竭呈正相关,提示HPK1可能是调节T细胞耗竭和抑制抗肿瘤免疫反应的关键激酶。
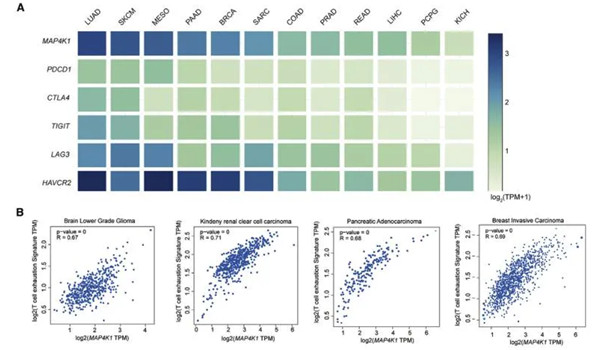
不同癌症患者的MAP4K1表达及与T细胞衰竭信号相关性
二、验证HPK1
为了进一步验证HPK1对T细胞的抗肿瘤活性或肿瘤细胞生长的影响,研究人员检测了HPK1在肿瘤细胞中的表达,发现HPK1在肿瘤细胞中很少表达。研究人员采用B16OVA模型,发现与野生小鼠相比,MAP4K1细胞中OVA特异性CD8+肿瘤浸润淋巴细胞(TILs)的数量增加,MAP4K1缺陷小鼠表现出脱颗粒标记物CD107a的表达增加,并在佛波醇PMA和离子霉素刺激下产生更多的颗粒酶B和干扰素-g(IFN-g)。因此, MAP4K1缺失的CD8+TILs不仅能减少衰竭,而且具有较强的抗肿瘤活性。
三、研究证实
之后研究人员进行相关机制研究,发现HPK1-Blimp1轴可驱动CD8+直到耗尽。研究人员先分析了肿瘤浸润性T细胞的RNA序列数据,发现HPK1基因敲除引起共抑制受体(如PDCD1、HAVCR2、LAG-3和CTLA-4)和凋亡相关基因(如ANXA1、FAS、BCL2L2、CASP3、CASP1和CASP4)的下调,细胞周期相关基因的上调(例如,GADD45B、CDKN2A、CDK2、CCNB1、MAD1L1、TFDP1、CDC25B和CDC25C),而小鼠体内蛋白表达水平也证实了该结果。
此外,在黑色素瘤患者中,PRDM1(编码Blimp 1)和TOX与MAP4K1呈显著正相关。先前的研究证明,HPK1作为一种关键的TCR近端激酶发挥作用,其通过阳性细胞调节肿瘤浸润性T细胞衰竭Blimp1表达对T细胞活化进行调控,而本研究中的一系列实验也证实了这一结果。
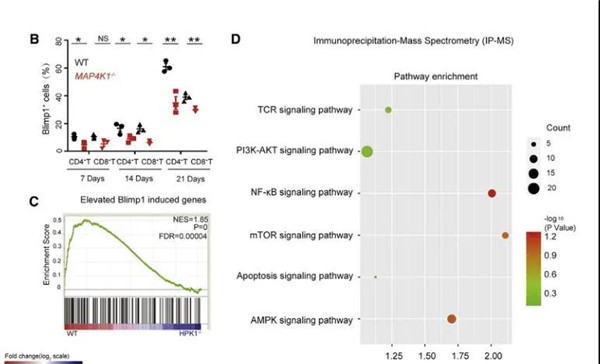
HPK1-Blimp1轴及HPK1与其他信号通路之间的相互作用
之后,研究人员进一步探讨了HPK1对嵌合抗原受体(CAR-T)细胞功能的影响。他们发现,与敲除了PD-1的 CAR-T细胞相比, 敲除MAP4K1的 CAR-T细胞对肿瘤细胞的毒性显著增强。
接下来,研究人员采用患者衍生的MM NSG小鼠模型,评估MAP4K1敲除的CAR-T细胞的临床前疗效和安全性。结果显示,与对照组相比,在体外培养的第7天,MAP4K1敲除的B细胞成熟抗原CAR-T细胞中TOX和GATA3的表达降低,TCF1的表达增加。此外,其可显著抑制肿瘤生长并延长小鼠存活期。与对照组相比,这种细胞显著产生的并不是更高的IL-6,而是更高的IFN-g和更少的IL-15,而且毒性更小。这些结果表明,敲除MAP4K1的CAR-T细胞明显地平衡了安全性和有效性。
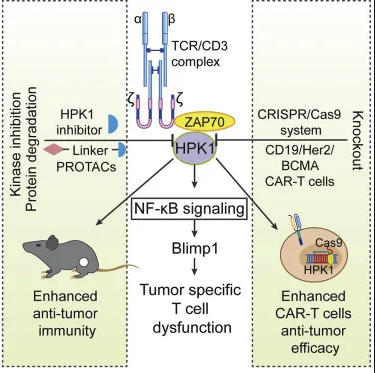
实验流程图
鉴于以上实验结果,研究人员开发了一系列HPK1的小分子抑制剂,最终发现ZYF0033对IC50小于10 nm的HPK1显示出良好的效价。
在毒性研究中,ZYF0033也凸显出了较大的优势。在小鼠模型中, ZYF0033抑制肿瘤生长并导致肿瘤内DC、NK细胞和CD107A+CD8+T细胞浸润增加,但减少了调节性T细胞、PD-1+CD8+T细胞、TIM-3+CD8+T细胞和LAG3+CD8+T细胞的浸润。随后的药物化学优化开发出了蛋白水解靶向嵌合体(PROTAC)试剂SS47并进行了一系列的实验验证了其安全性和有效性。
总结而言,遗传敲除、药理学抑制或PROTAC介导的HPK1降解在血液和实体瘤的各种临床前小鼠模型中提高了CAR-T细胞免疫疗法的功效。这些策略比在CAR-T细胞中遗传敲除PD-1更有效。
改善T细胞衰竭和增强效应子功能是增进免疫疗法的有效策略。因此,开发HPK1抑制剂或通过PROTACs降解HPK1可能是肿瘤免疫治疗研究的新前沿。
小艾:那就让我们一起期待改善T细胞衰竭和增强效应子功能的最终的有效策略出现吧。现在,听完科学家们的解读,T细胞,你怎么看。
T细胞:我太太太感动了,没想到中国的科学家们默默为了我做了这么多事情,我竟然将来有机会改善“衰竭”。
小艾:好的,感谢T细胞和各位科学家接受我的采访,那么采访到此就结束了,让我们镜头切到主持人。
主持人艾豆:好的,感谢小艾,原来HPK1是一个很有前途的肿瘤免疫治疗的候选靶点,真的是涨知识了。今天的《我艾看生物》到此结束,感谢艾美捷科技,每日生物评论对本节目的大力支持。各位下次见。
本文来源:生物探索 百度百科








