2020年9月23日,来自美国加州大学洛杉矶分校Helen E. Vuong课题组在《自然》发表了题为“The maternal microbiome modulates fetal neurodevelopment in mice.”的研究成果,研究表明小鼠母体微生物组可以调节胎儿的神经发育。
研究人员探究了小鼠母体肠道微生物组的缺失和选择性重建如何影响胎儿的神经发育。抗生素处理和饮食无菌水母体产生的胚胎中,其大脑表现出与轴突发生相关基因的表达减少、丘脑皮层轴突不足以及响应细胞外源因子的丘脑轴突生长受损。微生物群落耗竭后定植既定菌落的母体可防止胎儿脑基因表达和丘脑皮质轴突发生异常。
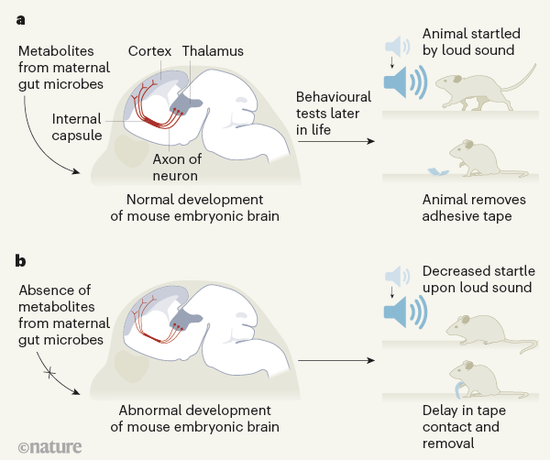
Fig. 1 | (来源nature)
代谢组学分析表明,母体微生物组调节母体血清和后代胎儿脑中的许多小分子。选择微生物群依赖性代谢产物可促进胎儿丘脑外植体的轴突生长。此外,孕妇补充这些代谢物可消除胎儿丘脑皮层轴突缺陷。对孕期母体微生物组和微生物代谢产物处理产生的成年后代在两种厌恶型体感行为模型中表现出触觉敏感性改变,但在许多其他感觉运动行为上没有明显差异。
总之,该发现表明,母体肠道微生物组可能通过微生物产生的代谢产物向发育中的胎儿大脑神经元发出信号,从而促进胎儿丘脑皮层轴突的发育。
据悉,由于应对怀孕期间感染、饮食改变和压力等挑战而导致的孕妇肠道微生物组“代谢失调”,越来越多地与后代脑功能和行为异常相联系起来。但是,尚不清楚母体肠道微生物组是否在关键的产前时期和没有环境挑战的情况下影响胎儿的神经发育。
(评论:这些发现为我们理解母体微生物如何影响正常的大脑发育提供了必要的基础,很可能与人类的健康也有关。)
文章来源:
Helen E. Vuong, Geoffrey N. Pronovost et al, The maternal microbiome modulates fetal neurodevelopment in mice. DOI: 10.1038/s41586-020-2745-3 Nature:最新IF:43.07
2、Neuron:揭示神经胶质细胞感受环境刺激和调节嗅觉适应性的新机制
2020年9月23日,浙江大学脑科学与脑医学学院 康利军教授团队和 段树民院士团队合作,在 Neuron 发表了题为 “Sensory gliadetect repulsive odorants and drive olfactory adaptation.” 的研究论文。该研究首次发现外周神经胶质细胞可以直接感受环境气味刺激,并通过GABA神经递质,实时抑制嗅觉神经元的活性,从而引起嗅觉适应性。
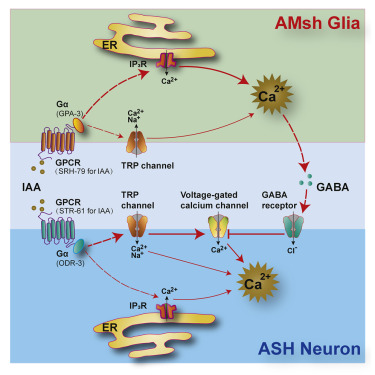
Fig 2| 来源Neuron
研究人员首先在模式生物秀丽隐杆线虫(C.elegans)的化感器鞘状胶质细胞(amphidsheath glia; AMsh glia)中特异性表达钙敏感的荧光蛋白GCaMP5,发现 无论在体还是离体分离培养的AMsh 胶质细胞都能够被机械刺激和厌恶性气味分子所激活。通过一系列分子遗传学筛选,研究人员发现两种GPCR蛋白SRH-79和STR-61,分别表达于AMsh 胶质细胞和ASH感觉神经元,作为受体蛋白感受气味分子IAA (isoamyl alcohol;异戊醇),并通过TRP通道和IP3R引起细胞内的钙升高响应。接下来,通过在AMsh 胶质细胞中表达光敏感通道蛋白(CoChR),采用光遗传学方法特异性操控AMsh胶质细胞活性,研究人员发现AMsh胶质细胞被激活以后,能够通过释放抑制性神经递质GABA,作用于ASH感觉神经元上的离子型GABA受体LGC-38,抑制ASH神经元对气味分子的响应,进而调节气场环境(IAA)中动物的嗅觉行为学模式。有意思的是,如果基因敲除AMsh胶质细胞上的IAA受体SRH-79,AMsh胶质细胞就失去了对IAA气味适应性的调控能力,但是仍然保持对1-octanol(辛醇)气味适应性的实时调节作用,充分说明了AMsh胶质细胞能够直接感受气味刺激,并实时调控嗅觉行为响应。
(评论:充分阐明神经胶质细胞的生理功能和感觉适应性的生成机制奠定了科学基础,并提示神经胶质细胞及其相关分子在神经精神疾病发生与相关药物开发中潜在的意义。)
文章来源:
Duo Duan*, Hu Zhang*, Xiaomin Yue*et al, Sensory gliadetect repulsive odorants and drive olfactory adaptation. doi.org/10.1016/j.neuron
3、Nature:Caspase-8通过切割N4BP1整合先天免疫信号
2020年9月24日,来自美国基因泰克公司Vishva M. Dixit、Kim Newton和斯坦福大学医学院Alexander D. Gitlin研究组合作在《自然》杂志上发表了题为“Integration of innate immune signaling by caspase-8 cleavage of N4BP1.”的研究成果,发现Caspase-8通过切割N4BP1整合先天免疫信号

Fig 3|来源:Nature
研究人员发现NEDD4结合蛋白1(N4BP1)被caspase-8切割并失活,N4BP1是细胞因子产生的抑制剂。缺失N4BP1的小鼠在Toll样受体(TLR)1/2、TLR7或TLR9的刺激下增加了选择性细胞因子的产生,但该过程不会发生在TLR3或TLR4诱导的反应中。N4BP1不会抑制野生型巨噬细胞中TLR3或TLR4的反应,这是由TRIF和caspase-8依赖性切割N4BP1所致。
值得注意的是,在caspase-8缺失的巨噬细胞中TLR3和TLR4细胞因子应答受损可通过共缺失N4BP1挽救。因此,完整N4BP1在caspase-8缺陷巨噬细胞中的持久存在会减弱其建立稳定细胞因子反应的能力。肿瘤坏死因子(TNF),如TLR3或TLR4的激动剂,也会引起caspase-8依赖性切割N4BP1,从而导致TRIF依赖性TLR产生更多的炎性细胞因子。
总的来说,该研究结果表明N4BP1是细胞因子应答的有效抑制剂,并揭示了Caspase8对N4BP1的切割是炎症信号的整合点;并解释由FADD-caspase-8突变引起的免疫缺陷。
据悉,死亡受体Fas或其配体FasL的突变会引起自身免疫性淋巴组织增生综合征(ALPS),而突变Fas/FasL介导的细胞死亡下游因子caspase-8或其配体FADD除了导致ALPS外还会产生严重的免疫缺陷。小鼠模型也证实了FADD-caspase-8在促进炎症反应中的功能,但免疫缺陷的潜在机制仍然未知。
(评论:学习了)
文章来源:
Alexander D. Gitlin, Klaus Heger et al,Integration of innate immune signaling by caspase-8 cleavage of N4BP1. doi.org/10.1038/s41586-020-2796-5,Nature:最新IF:43.07