1、Nature Genetics:确定癌症免疫逃逸的机制
2021年3月1日,来自美国哥伦比亚大学Benjamin Izar和麻省理工学院Aviv Regev研究组合作在《自然-遗传学》杂志上发表了题为“Multimodal pooled Perturb-CITE-seq screens in patient models define mechanisms of cancer immune evasion.”的研究成果,研究中利用患者模型中的多模式混合Perturb-CITE-seq筛查确定了癌症免疫逃逸的机制。
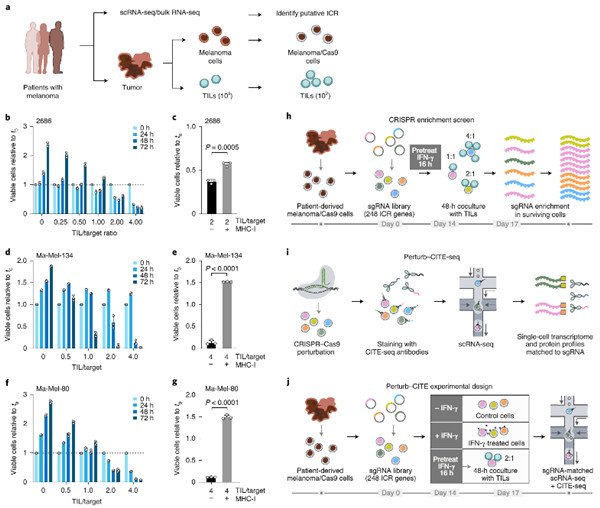
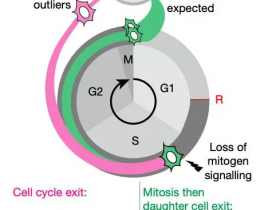
Fig 1|来源(Nature Genetics)
为了阐明检查点抑制剂(ICIs)的耐药性潜在的机制,他们开发了Perturb-CITE测序(Perturb-CITE-seq),从而可以通过单细胞转录组和蛋白读数合并聚集的规则间隔的短回文重复序列(CRISPR)-Cas9扰动。在患者来源的黑色素瘤细胞和自体肿瘤浸润淋巴细胞(TIL)的共培养物中,他们在约750扰动与癌细胞内源性ICI抗性(ICR)相关的218,000细胞中分析了转录组和20种蛋白。他们恢复了已知的耐药机制,包括干扰素-γ(IFN-γ)–JAK / STAT的缺陷以及RNA、蛋白质和微扰空间中的抗原呈递途径,以及新的机制,包括CD58的丢失/下调。
CD58的丧失在多种共培养模型中均导致免疫逃逸,并在ICR黑色素瘤患者的肿瘤中被下调。CD58蛋白的表达不受IFN-γ信号的诱导,并且CD58的丧失在不损害主要组织相容性复合物(MHC)表达的情况下提供了免疫逃逸,表明它与ICR的已知机制正交。这项工作通过具有多模式单细胞读数的大规模干扰筛查为破译复杂机制提供了框架,并发现了潜在的临床上与免疫逃逸有关的机制。
(评论:研究人员使用CRISPR,使这250个基因逐一失活,以创建250批黑色素瘤细胞的混合物,每个细胞都有不同的突变。然后将整个“编辑后”的癌细胞的混合物暴露于接受检查点抑制剂治疗后的患者T细胞。)
文章来源:
Chris J. Frangieh, Johannes C. Melms et al, Multimodal pooled Perturb-CITE-seq screens in patient models define mechanisms of cancer immune evasion., DOI: 10.1038/s41588-021-00779-1, 最新IF:25.455
2021年3月3日,来自美国宾夕法尼亚大学Erika L. F. Holzbaur研究团队在《自然》杂志发表了题为“Actin cables and comet tails organize mitochondrial networks in mitosis.”的研究成果,发现肌动蛋白网络和彗星尾巴在有丝分裂过程中参与线粒体网络的组装。
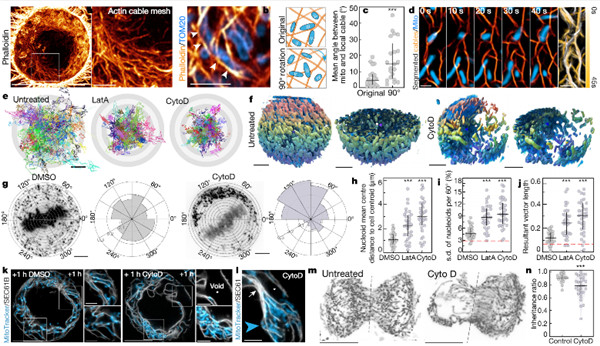
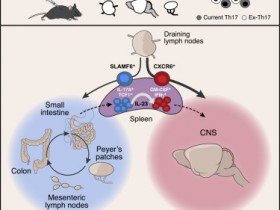
Fig 2|来源(nature)
研究人员发现了在有丝分裂过程中与线粒体组织和遗传相关的独特但互补的多个肌动蛋白组装体。首先,研究人员发现了在有丝分裂细胞质中由皮下肌动蛋白组装成的致密网络。该网络支撑内质网并组织三维线粒体定位,以确保胞质分裂时线粒体可以均等分离。
其次,研究确定在有丝分裂期间,肌动蛋白丝在线粒体表面形成可逆地组装动态波。具有动态波的线粒体包裹在肌动蛋白网中,肌动蛋白网可自发地破坏其对称性,从而形成细长的彗星尾巴。线粒体彗星尾巴会促进随机定向运动的爆发,从而改变母细胞中线粒体的位置,使子细胞之间健康和受损线粒体的遗传随机化。因此,肌动蛋白细胞骨架介导的平行机制确保了对称分裂细胞中线粒体的均等和随机遗传。
(评论:尽管众所周知调控基因组分离的机制,但对确保子细胞之间细胞器分离的机制仍知之甚少。)
文章来源:
Andrew S. Moore, Stephen M. Coscia et al, Actin cables and comet tails organize mitochondrial networks in mitosis. DOI: 10.1038/s41586-021-03309-5, Nature:最新IF:25.455
3、Nature:MAP3K2调控的肠道基质细胞可定义一种独特的干细胞微环境
2021年3月2日,来自上海交通大学医学院苏冰研究组在《自然》杂志发表了题为“MAP3K2-regulated intestinal stromal cells define a distinct stem cell niche.”的研究成果,发现MAP3K2调控的肠道基质细胞可定义一种独特的干细胞微环境。
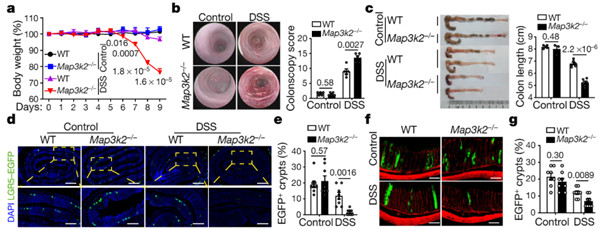
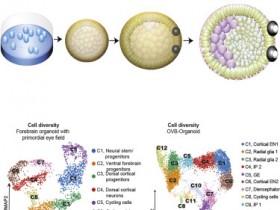
Fig 3|来源(nature)
研究人员报道了一类肠基质细胞的亚群,被命名为MAP3K2调节的肠基质细胞(MRISCs),并发现它们是小鼠肠损伤后WNT激动因子R-spondin 1的主要细胞来源。MRISCs在表观遗传学和转录组学上不同于先前报道的小肠基质细胞亚型,其策略性地定位在结肠隐窝的底部,并起维持LGR5+小肠干细胞的作用,并防止急性小肠损伤通过增强的R-spondin 1生产。
从机理上讲,这种MAP3K2的特定功能是由先前未知的活性氧(ROS)–MAP3K2–ERK5–KLF2信号轴介导的,从而增强R-spondin 1的产生。这些研究结果表明,MRISCs是肠道干细胞微环境的关键组成部分,它特别依赖于MAP3K2来增强WNT信号,从而再生受损的肠道。
(评论:多样化的基质细胞群维持组织稳态和修复的具体细胞和分子机制目前还不是很了解)
文章来源:
Ningbo Wu, Hongxiang Sun et al, MAP3K2-regulated intestinal stromal cells define a distinct stem cell niche. DOI: 10.1038/s41586-021-03283-y, Nature:最新IF:43.07