1、Science:人次要剪接体活性位点和催化中心的三维结构
2021年1月28日,来自西湖大学施一公教授和万蕊雪研究团队合作在《科学》发表了发表了题为“Structure of the activated human minor spliceosome.”的研究成果,解析了人次要剪接体活性位点和催化中心的三维结构。
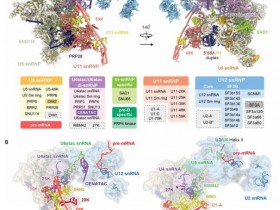
研究人员利用冷冻电镜解析了人次要剪接体激活态分辨率为2.9-Å的原子特征。U12型内含子的5'剪接位点和分支点序列分别被U6atac和U12小核仁RNA(snRNA)识别。五个新发现的蛋白质可稳定催化中心构象。锌指蛋白SCNM1模拟了主要剪接体SF3a复合体的功能。
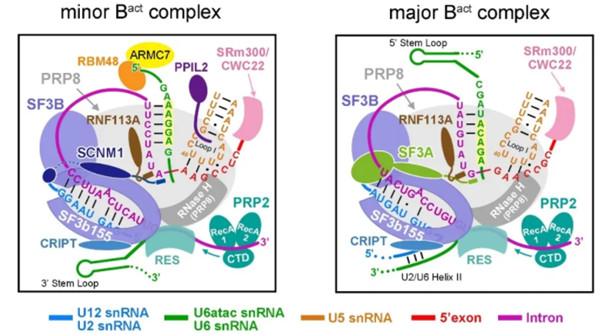
Fig 1|次要剪接体与主要剪接体的结构差异
RBM48/ARMC7复合物在U6atac snRNA的5'末端结合了γ-单甲基磷酸酯帽。U-box蛋白PPIL2协同调节U5 snRNA的环I,并使U5 snRNP稳定。CRIPT稳定了U12 snRNP。该研究为理解次要剪接体的功能提供了前提。
研究人员表示,次要剪接体介导了罕见但必需的U12型前体mRNA的剪接。
(评论:首次报道了迄今整体研究知之甚少的次要剪接体的高分辨率三维结构,展示了在剪接反应中的一个关键构象——激活态次要剪接体)
文章来源:
Rui Bai, Ruixue Wan, Lin Wang et al, Structure of the activated human minor spliceosome. DOI: 10.1126/science.abg0879, Science:最新IF:41.037
2、Cell:发现G3BP将TSC复合物束缚于溶酶体并抑制mTORC1信号传导
2021年1月25日,来自德国奥尔登堡卡尔·冯·奥西茨基大学Kathrin Thedieck和德国转化癌症研究联盟(DKTK)及德国癌症研究中心(DKFZ)Christiane A. Opitz合作在《细胞》杂志发表了题为“G3BPs tether the TSC complex to lysosomes and suppress mTORC1 signaling.”的研究成果,发现G3BP(Ras GTPase激活蛋白结合蛋白)将TSC复合物束缚于溶酶体并抑制mTORC1信号传导。
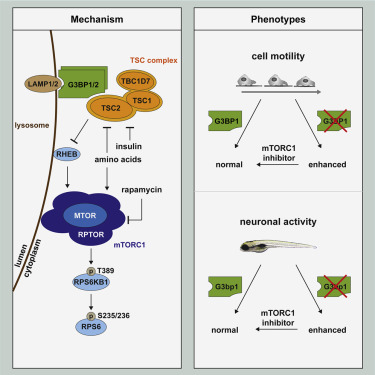
Fig 2|来源cell概图
他们报告G3BPs驻留在溶酶体的细胞质表面。它们以非冗余方式将结节性硬化(TSC)蛋白复合物锚定在溶酶体上,并抑制氨基酸和胰岛素激活雷帕霉素复合物1(mTORC1)的代谢主调控子机制靶标。像TSC复合体一样,G3BP1缺乏引起与mTORC1过度活跃有关的表型。在肿瘤中,低G3BP1水平会增强mTORC1驱动的乳腺癌细胞运动,并与患者的不良预后相关。
此外,斑马鱼中的G3bp1抑制会干扰神经元的发育和功能,导致白质异位症和神经元过度活跃。因此,G3BPs不仅是应激颗粒(SGs)的核心组成部分,还是溶酶体TSC-mTORC1信号转导的关键因素。
研究人员表示,G3BP1和G3BP2被广泛认为是SGs的核心成分。
(评论:MTOR出现故障,则可能导致神经系统的癌症和发育障碍,从而导致行为障碍和癫痫病,而这项研究发现G3BP可抑制mTORC1信号传导,这将在癌症和发育性脑疾病中起重要作用,这可能为癌症和神经元疾病的个性化治疗开辟新的机会。)
文章来源:
Mirja Tamara Prentzell, Ulrike Rehbein et al, G3BPs tether the TSC complex to lysosomes and suppress mTORC1 signaling , DOI: 10.1016/j.cell.2020.12.024 ,Cell:最新IF:36.216
2021年1月27日,来自以色列特拉维夫大学Uri Ben-David团队在期刊《自然》发表了题为“Aneuploidy renders cancer cells vulnerable to mitotic checkpoint inhibition.”的研究进展,发现非整倍性使癌细胞对有丝分裂检查点更敏感。
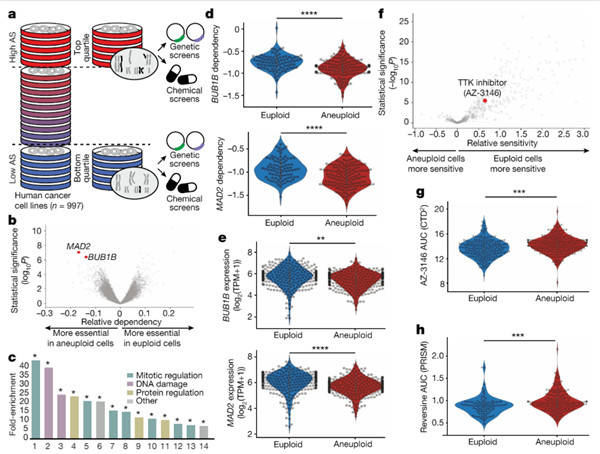
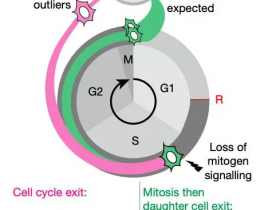
Fig 3|非整倍体癌细胞对纺锤体组装检查点抑制的差异敏感性文章来源 nature
研究人员绘制了约1,000种人类癌细胞系的非整倍性图谱,并分析了遗传和化学扰动筛选,以确定与非整倍性相关的细胞靶点。研究人员发现非整倍体癌细胞对纺锤体装配检查点(SAC)核心组件的遗传扰动表现出更高的敏感性,从而确保有丝分裂期间染色体的正确分离。出乎意料的是,研究人员还发现非整倍体癌细胞对短期暴露于多种SAC抑制剂的敏感性低于二倍体癌细胞。
实际上,随着时间的推移,非整倍体癌细胞对SAC抑制作用变得越来越敏感。非整倍体细胞表现出异常的纺锤体几何形状和动力学,并在抑制SAC时保持分裂,导致有丝分裂缺陷的积累,并形成不稳定且不太适合的核型。因此,尽管非整倍体癌细胞比二倍体细胞更容易克服SAC抑制作用,但它们的长期增殖受到威胁。
研究人员确定了一种特定的有丝分裂驱动蛋白,KIF18A,其活性在非整倍性癌细胞中受到干扰。非整倍体癌细胞特别容易耗尽KIF18A,并且KIF18A过表达恢复了它们对SAC抑制的反应。这些结果确定了非整倍性与SAC之间在治疗上相关的合成致死相互作用。
(评论:非整倍体细胞的选择性靶向是一种潜在的癌症治疗策略。然而,目前尚不清楚非整倍性是否会在癌细胞中产生任何临床相关的治疗靶点。)
文章来源:
Yael Cohen-Sharir, James M. McFarland et al, Aneuploidy renders cancer cells vulnerable to mitotic checkpoint inhibition. DOI: 10.1038/s41586-020-03114-6, Nature:最新IF:43.07