1、Nature:祁海研究团队揭示高亲和力抗体筛选的新机制
2021年2月17日,来自清华大学祁海研究团队在期刊《自然》发表了题为“Affinity-coupled CCL22 promotes positive selection in germinal centres.”的研究成果,揭示高亲和力抗体筛选的新机制。
据研究人员介绍,抗体亲和力成熟取决于稀有B细胞克隆在生发中心(GC)的正向选择,这些B细胞克隆通过体细胞超突变获得更高亲和力的B细胞受体,向滤泡性辅助T(TFH)细胞呈递更多的抗原,因此获得更多的接触依赖性T细胞帮助。由于这些GC B细胞和TFH细胞在混乱的GC环境中无法保持持久的接触,因此尚不清楚有足够的T细胞帮助累积地集中在那些稀有克隆上。
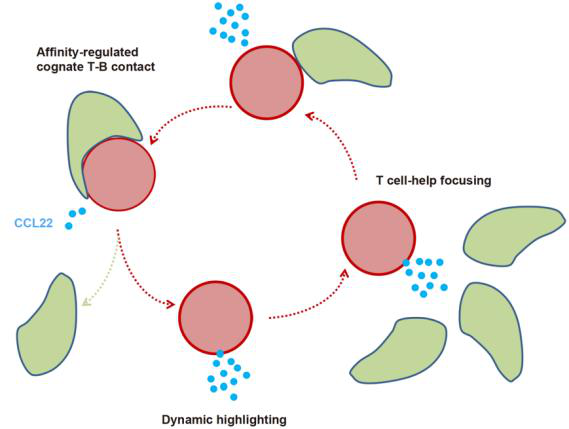
Fig 1| the model of chemoattraction-driven remote sensing of affinity information.(nature截图)
研究人员表明,在刺激CD40后,GC B细胞上调趋化因子CCL22,并在较小程度上上调CCL17。通过将趋化因子受体CCR4结合到TFH细胞上,CCL22和CCL17可以从远处吸引多个辅助细胞,从而增加了产生帮助的机会。在GC反应期间,获得更高抗原结合亲和力的B细胞表达更高水平的CCL22,从而“突显”这些高亲和力的GC B细胞。TFH细胞的急性增加或阻断分别有助于快速增加或减少GC B细胞的CCL22表达。
因此,基于趋化因子的细胞间反应回路将单个B细胞最近获得的T细胞帮助量与其随后吸引更多帮助的能力联系起来。当在B细胞中敲除CCL22和CCL17时,GC能够形成,但B细胞不能有效地亲和成熟。当在同一反应中与野生型B细胞竞争时,缺乏CCL22和CCL17的B细胞获得的T细胞帮助维持GC参与或发展为骨髓浆细胞的帮助较少。通过揭示一种趋化因子介导的机制,其突出显示了亲和力提高的B细胞对TFH细胞的优先帮助,这项研究揭示了GC正向选择的时空调控原理。
(评论:暗示人生发中心有类似机制在工作,可能为抗体疫苗设计提供新思路。)
文章来源:
Bo Liu, Yihan Lin, Jiacong Yan et al, Affinity-coupled CCL22 promotes positive selection in germinal centres. DOI: 10.1038/s41586-021-03239-2, Nature:最新IF:43.07
2、Immunity:吕奔课题组肝素可预防caspase-11依赖的败血症致死
2021年2月8日,来自中南大学吕奔课题组在学术期刊《免疫》发表了题为“Heparin prevents caspase-11-dependent septic lethality independent of anticoagulant properties.”的研究成果,发现肝素可预防caspase-11依赖的败血症致死,与其抗凝特性无关。
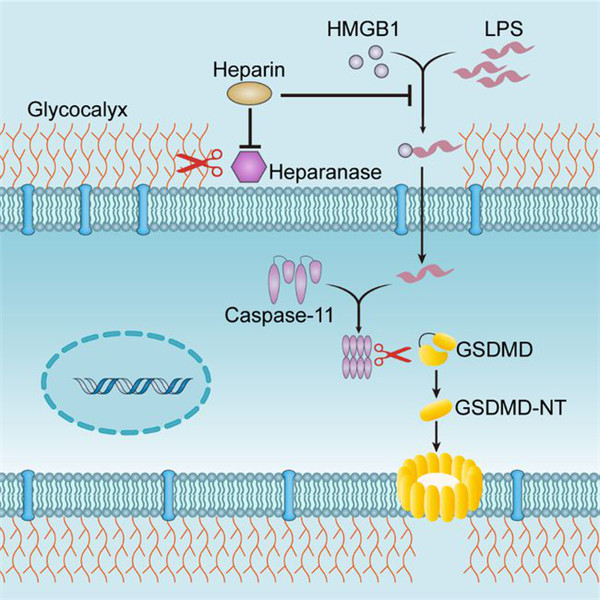
Fig 2|肝素抑制LPS胞浆内转运的分子机制 (来源:Immunity)
研究人员表明,肝素可预防脓毒症中caspase-11依赖性免疫反应和致死性,而与其抗凝特性无关。肝素或无抗凝功能的化学修饰形式的肝素抑制了警报蛋白HMGB1-脂多糖(LPS)相互作用,并阻止了乙酰肝素酶巨噬细胞糖萼的降解。这些事件阻止了巨噬细胞中LPS的胞质传递和caspase-11的激活,后者是一种介导败血症致死性的胞质LPS受体。接受肝素治疗的败血症患者生存率高于未接受肝素治疗的患者。
对这种以前未知肝素功能的鉴定建立了先天免疫反应与凝血之间的联系。
据了解,肝素是一种哺乳动物多糖,也是一种广泛用于治疗血栓形成疾病的抗凝药物。它还能够改善败血症的结局,败血症是由感染引起的免疫功能障碍导致死亡的主要原因。尽管相对清楚的是肝素如何发挥其抗凝作用,但肝素所能实现的免疫调节机制仍然是个谜。
(评论:该研究发现了肝素调节免疫反应的作用靶标,分离了其抗凝与抗炎作用,揭示了肝素或非抗凝活性肝素在脓毒症中的保护作用及药理学机制,并为脓毒症的防治提供了新的思路。)
文章来源:
Yiting Tang, Xiangyu Wang et al, Heparin prevents caspase-11-dependent septic lethality independent of anticoagulant properties. DOI: 10.1016/j.immuni.2021.01.007, Immunity:最新IF:21.522
3、Nature Structural & Molecular Biology:龚欣课题组揭示鞘脂合成关键膜蛋白复合物的组装和底物选择性分子机制
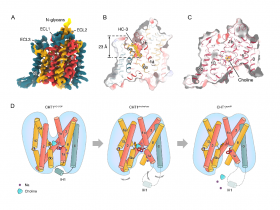
2021年2月8日,来自南方科技大学龚欣副教授课题组在Nature Structural & Molecular Biology杂志发表了题为“Structural insights into the assembly and substrate selectivity of human SPT-ORMDL3.”的研究成果,首次报道了鞘脂合成第一步也是整个鞘脂合成过程限速步骤的关键酶——人源丝氨酸棕榈酰转移酶SPT及SPT-ORMDL3复合物的三维结构, 揭示了复合物详细的分子结构和各亚基之间组装的分子机制, 同时还报道了SPT-ORMDL3与底物的复合物结构,通过广泛的突变位点研究,揭示了底物结合和选择性的分子机理。
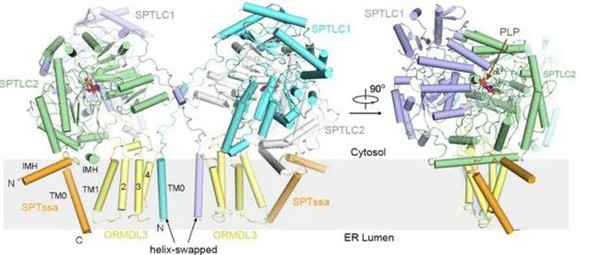
Fig 3|二聚化SPT-ORMDL3复合物的整体结构
人丝氨酸棕榈酰转移酶(SPT)复合物催化所有鞘脂从头生物合成的初始和限速步骤。ORMDLs调节SPT功能,人类ORMDL3与哮喘相关。本文报道了三种高分辨率的低温电镜结构:人类SPT复合体,由SPTLC1、SPTLC2和SPTssa组成;SPT-ORMDL3复杂;SPT-ORMDL3络合物结合在两个底物上,plp - l-丝氨酸(PLS)和一个不反应的棕榈酰辅酶a类似物。SPTLC1和SPTLC2形成异源二聚体的二聚体作为催化核心。SPTssa参与酰基辅酶a配位,从而刺激SPT活性,调节底物选择性。ORMDL3位于综合体的中心,用于稳定SPT组件。我们的结构和生化分析为SPT和SPT - ormdl3复合物的组装和底物选择性提供了分子基础,并为了解鞘脂稳态机制和开发相关治疗药物奠定了基础。
(评论:该研究中的高分辨率结构信息为了解鞘脂稳态调控的机制提供了新起点,并为以后的研究和药物发现提供了重要的分子基础。)
文章来源:
Sisi Li, Tian Xie, Peng Liu et al, Structural insights into the assembly and substrate selectivity of human SPT–ORMDL3 complex. https://www.nature.com/articles/s41594-020-00553-7, nature structural & molecular biology