1、Science:Z-DNA结合蛋白1能够促进中暑诱导的细胞死亡
2022年5月6日,来自中南大学湘雅第三医院Ben Lu团队在《科学》杂志上发表了题为“Z-DNA binding protein 1 promotes heatstroke-induced cell death.”得研究成果,他们发现Z-DNA结合蛋白1能够促进中暑诱导的细胞死亡。
中暑是一种由热应激引起的危及生命的疾病,与循环衰竭和多器官功能障碍有关。 高体温诱发的危重症为热射病(Heatstroke,又称“重度中暑”)。随着全球气候变暖,热射病引起的死亡人数逐年增加。脓毒症与热射病常表现为全身炎症反应、弥散性血管内凝血(DIC)和多脏器衰竭。但感染和高体温如何诱导上述病理生理学反应的机理过去不甚清楚。
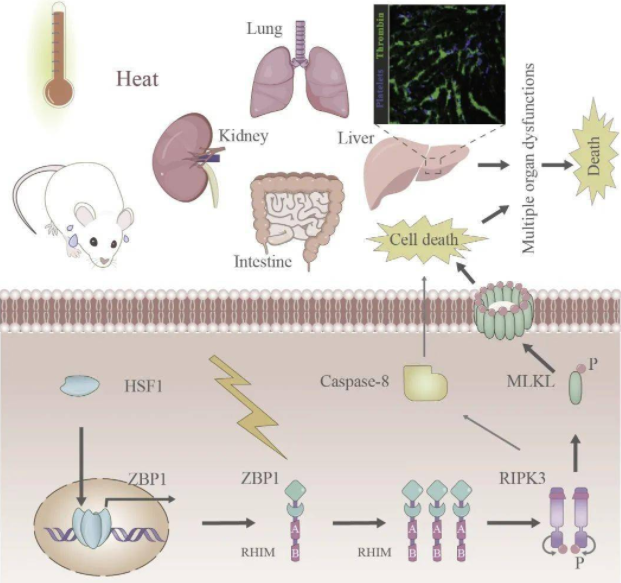
Fig 1|热应激诱导细胞程序性死亡及多脏器损伤的分子机制模式图
研究人员发现Z-DNA结合蛋白 1 (ZBP1),一种 Z-核酸受体,通过触发受体相互作用蛋白激酶 3 (RIPK3) 依赖性细胞死亡来介导中暑。 热应激通过热休克转录因子 1 (HSF1) 增加ZBP1的表达,并通过独立于核酸传感作用的机制激活ZBP1。ZBP1、RIPK3或混合谱系激酶域样 (MLKL) 和caspase-8的缺失降低了热应激诱导的循环衰竭、器官损伤和致死率。 因此,ZBP1似乎具有协调宿主对热应激反应的第二个功能。
(评论:揭示了高体温通过诱发ZBP1依赖的程序性细胞死亡在热射病发生发展中引起的致死效应,颠覆了既往的学术观点“高体温通过物理性损伤导致脏器功能衰竭”,展示了温度感应、程序性细胞死亡、DIC与脏器功能衰竭之间的内在联系,为热射病等危重症的防治提供了重要思路。)
文章来源:
Fangfang Yuan, Jizhen Cai et al, Z-DNA binding protein 1 promotes heatstroke-induced cell death. DOI: abg5251 Science:最新IF:41.037
2、Nature:可逆RNA磷酸化通过稳定tRNA来提高细胞耐热性
2022年4月27日,来自日本东京大学Tsutomu Suzuki研究组以及Kozo Tomita研究组合作在Nature上发表了题为“Reversible RNA phosphorylation stabilizes tRNA for cellular thermotolerance.”的研究成果,揭开了超嗜热古细菌tRNA上新型磷酸化修饰,并确认了该修饰在维持热稳定性中的作用。
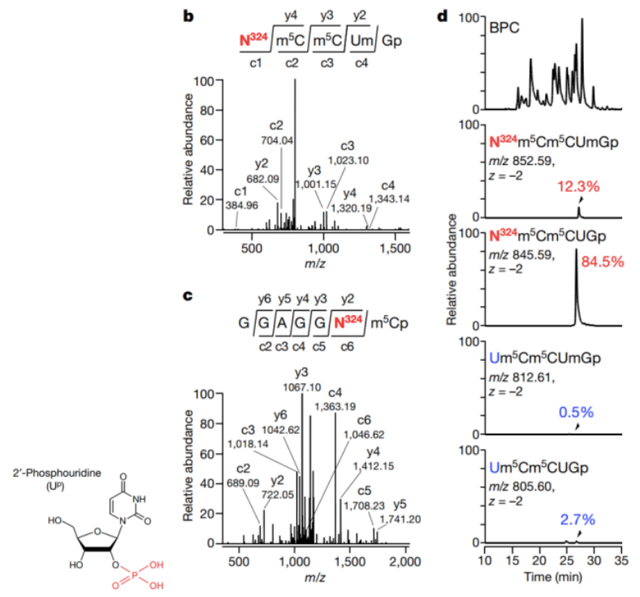
Fig 2 | Up47磷酸化修饰
来自嗜热古生菌的 tRNA 的第 47 位鉴定了 2'-磷酸尿苷(简称Up)。Up47 赋予 tRNA 热稳定性和核酸酶抗性。原生古菌 tRNA 的原子结构显示出由 Up47 稳定的独特亚稳态核心结构。Up47 的 2'-磷酸从 tRNA 核心突出并防止热变性过程中的骨架旋转。此外,他们鉴定了 arkI 基因,该基因编码一种负责 Up47 形成的古生菌 RNA 激酶。结构研究表明,ArkI 具有一个非经典激酶基序,周围环绕着一个用于 tRNA 结合的带正电荷的补丁。一种 arkI 敲除菌株在高温下生长缓慢,当第二种 tRNA 修饰酶耗尽时表现出合成生长缺陷。他们还鉴定了 KptA 的古细菌同系物作为在体外和体内有效地使 Up47 去磷酸化的橡皮擦。
(评论:首次发现了tRNA上转录后磷酸化修饰,对于超嗜热古细菌耐热性非常关键,同时也找出了Up47磷酸化修饰相关的激酶和磷酸酶,为表观遗传修饰的研究提供了一个新的纬度。)
文章来源:
Ohira, Takayuki, Minowa et al, Reversible RNA phosphorylation stabilizes tRNA for cellular thermotolerance. DOI: 10.1038/s41586-022-04677-2, Nature:最新IF:43.07
3、Nature:性腺激素受体的基因调节是大脑性别差异的基础
2022年5月4日,来自美国冷泉港实验室J. Tollkuhn研究小组在《自然》杂志上发表了题为“Gene regulation by gonadal hormone receptors underlies brain sex differences.”的研究论文,性腺激素受体的基因调节是大脑性别差异的基础。
据悉,雌二醇在许多脊椎动物中建立了神经上的性别差异,并在成年后调节情绪、行为和能量平衡。在经典途径中,雌二醇通过转录因子ERα发挥其作用。虽然ERα在乳腺癌中已被广泛描述,但ERα的神经元靶点以及它们在大脑性别差异中的参与情况在很大程度上仍是未知的。
研究人员产生了一个全面的雌激素受体-α(ERα)基因组结合位点图谱,该图谱在一个介导社会行为的性双态神经回路中。研究人员结论是,ERα通过两种机制协调小鼠大脑的性分化:建立两种偏向男性的神经元类型和激活一个持续的偏向男性的基因表达程序。总之,这些研究结果显示,基因表达的性别差异是由激素对神经元类固醇受体的激活决定的。这项确定的分子靶标可能是雌二醇对大脑发育、行为和疾病影响的基础。
(评论: ERα通过两种机制协调小鼠脑的性别分化:建立两种雄性偏倚的神经元类型并激活持续的雄性偏倚基因表达程序。)
文章来源:
Gegenhuber, B., Wu, M. V., Bronstein, R., Tollkuhn, J. Gene regulation by gonadal hormone receptors underlies brain sex differences. DOI: 10.1038/s41586-022-04686-1. Nature:最新IF:43.07