1、Science:癌细胞的逃逸机制
2022年4月29日,来自丹麦哥本哈根大学Claus S. Sørensen研究团队在出版的《科学》上发表了题为“Cancer cells use self-inflicted DNA breaks to evade growth limits imposed by genotoxic stress.”的研究论文,发现癌细胞利用自身产生的DNA断裂,来避免由基因毒性带来的生长限制。
据介绍,诸如放射类基因毒性疗法是一线癌症治疗方法,但容易导致肿瘤复发性获得性耐药的产生。
Fig 1|有丝分裂
研究人员发现癌细胞在放疗期间通过可逆地增加全基因组DNA断裂来维持活力,从而限制有丝分裂进程的提前开启。研究人员发现半胱天冬酶激活的DNase(CAD)是造成特异位点从头DNA损伤的核酸酶,这些位点靠近染色质修饰CCCTC结合因子(CTCF)位点。CAD核酸酶活性由DNA损伤反应激酶的磷酸化调控,与半胱天冬酶的活性无关。
反过来,CAD活性的丧失会损害细胞命运决定,使癌细胞容易受到辐射诱导DNA双链断裂的影响。该研究发现癌症可选择性适应环境,即肿瘤细胞通过调节DNA断裂来限制治疗引起DNA损伤的有害影响。
(评论:该研究发现并证实了癌细胞在面对放疗压力时启动的一种独特的生存机制,即通过半胱天冬酶激活的DNA酶(CAD)来主动造成自身 DNA 断裂,从而导致癌细胞在细胞分裂间期 G2 期停滞,为修复放疗导致的 DNA 损伤增加时间。抑制 CAD 功能,能够让癌细胞对放疗更加敏感,而不影响正常细胞,这为将来改善放疗治疗效果提供了新的靶点。)
文章来源:
Brian D. Larsen, Jan Benada et al, Cancer cells use self-inflicted DNA breaks to evade growth limits imposed by genotoxic stress. Science:最新IF:41.037
2、Cell:哺乳动物组织中细胞药物靶点的原位鉴定
2022年4月27日,来自美国斯克里普斯研究所Li Ye研究组在学术期刊《细胞》发表了发表了题为“In situ identification of cellular drug targets in mammalian tissue.”的研究成果,研究开发了哺乳动物组织中细胞药物靶点的原位鉴定技术。
据了解,在完整组织中,缺乏细胞分辨率水平药物-靶标相互作用的观察工具,这一直是理解体内药物作用的主要障碍。
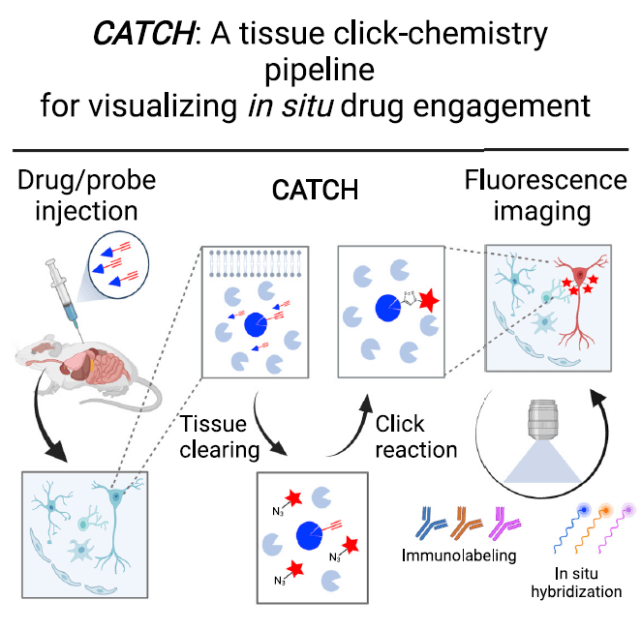
Fig 2| CATCH实现小分子药物成像的实验流程示意图
他们开发了清除辅助组织点击化学 (CATCH)技术,在完整哺乳动物组织中,用光学成像共价药物靶标。 CATCH 允许以亚细胞分辨率对靶结合的药物分子进行特异性和稳健的原位荧光成像,并能够识别靶细胞类型。使用成熟的内源性大麻素水解酶和单胺氧化酶抑制剂,直接或竞争性进行 CATCH, 不仅揭示了小鼠大脑中不同药物化合物的不同解剖分布和主要细胞靶点,而且揭示了大脑区域之间和大脑区域内药物参与的意外差异,也反映了罕见的细胞类型作为剂量依赖性靶点在组织、细胞和亚细胞区室中转移,而这些区室是传统方法无法获得的。CATCH 代表了一个有价值的平台,用于可视化组织中小分子的体内相互作用。
(评论:CATCH帮助我们窥见前所未见的细节,而它展现出的前景同样值得期待。CATCH带来的高分辨率成像,将为理解小分子药物功效与潜在的副作用机制带来新的机遇。)
文章来源:
Zhengyuan Pang, Michael A. Schafroth et al, In situ identification of cellular drug targets in mammalian tissue. Cell: DOI: 10.1016/j.cell.2022.03.040, 最新IF:36.216
3、Nature:气候变化增加跨物种的病毒传播风险。
2022年4月28日,来自美国乔治敦大学Colin J. Carlson、Gregory F. Albery等研究人员合作在在学术期刊《自然》发表了题为“Climate change increases cross-species viral transmission risk.”的研究成果,发现气候变化增加跨物种的病毒传播风险。
据介绍,至少有10,000种病毒有能力感染人类,但目前,绝大多数病毒在野生哺乳动物中默默地循环。然而,气候和土地利用的变化将为以前地理上隔离的野生动物物种之间的病毒共享提供新的机会。在某些情况下,这将促进人畜共患病的溢出,这是全球环境变化和疾病出现之间的机制联系。
研究人员利用哺乳动物-病毒网络的系统地理学模型,模拟了未来病毒共享的潜在热点,并预测了2070年气候变化和土地利用情况下3139种哺乳动物的地理范围变化。研究人员预测,物种将在高海拔地区、生物多样性热点地区以及亚洲和非洲的高人口密度地区以新的组合方式聚集,推动其病毒的新的跨物种传播,估计达4000次。由于其独特的传播能力,蝙蝠占了新型病毒共享的大部分,而且很可能沿着进化途径共享病毒,这将促进未来在人类中的出现。
令人惊讶的是,研究人员发现这种生态过渡可能已经在进行中,在本世纪内将升温控制在2℃以下不会减少未来的病毒共享。这些研究结果突出表明,迫切需要将病毒监测和发现工作与生物多样性调查结合起来,跟踪物种的范围转移,特别是在热带地区,这些地区孕育着最多的人畜共患病,并且正在经历快速变暖。
(评论:看来2019仅仅是新的开始)
文章来源:
Carlson, Colin J., Albery et al, Climate change increases cross-species viral transmission risk. DOI: 10.1038/s41586-022-04788-w, Nature:最新IF:43.07







