2022年3月18日,来自美国哈佛大学和麻省理工学院布罗德研究所Todd R. Golub和Peter Tsvetkov团队合作在《科学》杂志上发表了标题为“Copper induces cell death by targeting lipoylated TCA cycle proteins.”的研究文章,铜通过靶向脂酰化三羧酸 (TCA) 循环蛋白诱导细胞死亡。
据介绍,铜是所有生物体必不可少的辅助因子,但如果浓度超过进化保守的稳态机制维持的阈值,它就会变得有毒。然而,过量的铜如何诱导细胞死亡尚不清楚。研究人员将这种铜离子诱导细胞死亡的机制命名为 “铜死亡” (Cuproptosis)。
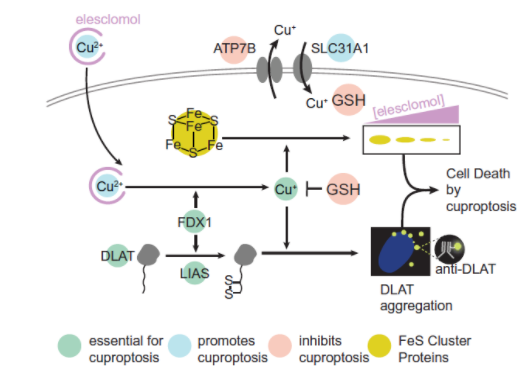
(铜死亡信号通路)
在人类细胞中,依赖于铜的、受调节的细胞死亡不同于已知的死亡机制,并且依赖于线粒体呼吸。他们表明,铜依赖性死亡是通过铜与TCA循环的脂酰化成分直接结合而发生的。这导致脂酰化蛋白质聚集和随后的铁硫簇蛋白质丢失,从而导致蛋白质毒性应激并最终导致细胞死亡。这些发现可以解释对铜稳态机制的需求。
铜离子载体诱导一种独特形式的调控细胞死亡;使用其他已知细胞死亡机制的抑制剂治疗—包括铁死亡、坏死性凋亡和氧化应激—都未能消除铜离子载体诱导的细胞死亡,表明这是一种与已知细胞死亡途径不同的机制。
线粒体呼吸调节铜离子载体诱导的细胞死亡;更依赖线粒体呼吸的细胞对铜离子载体的敏感性是糖酵解细胞的近1000倍,用线粒体抗氧化剂、脂肪酸和线粒体功能抑制剂处理对铜离子载体的敏感性具有非常明显的影响。线粒体解偶联剂 FCCP 对铜毒性没有影响,这表明铜诱导的细胞死亡需要线粒体呼吸,而不是三磷酸腺苷 (ATP) 的产生。
FDX1和蛋白质脂酰化是铜离子载体诱导细胞死亡的关键调节因子;为了确定介导铜毒性的特定代谢途径,研究人员进行了全基因组 CRISPR-Cas9 功能丧失筛选,以确定参与铜离子载体诱导死亡的基因。发现敲除FDX1基因(该基因编码的蛋白可以将二价铜离子转化为毒性更强的一价铜离子)以及六个脂酰化蛋白质基因(LIPT1、DLD、LIAS、DLAT、PDHA1、PDHB)可以挽救铜离子对细胞的杀伤作用。
FDX1 是蛋白质脂酰化的上游调节因子;蛋白质脂酰化是一种高度保守的赖氨酸翻译后修饰,已知仅在四种酶上发生,所有这些酶都涉及调节碳进入TCA循环的代谢复合物。
铜直接结合并诱导脂酰化DLAT的寡聚化;从细胞裂解物中纯化了DLAT和 DLST,发现这些蛋白质与带铜的树脂结合,但不与钴或镍树脂结合。当FDX1缺失消除蛋白质脂酰化时,DLAT和DLST不再与铜结合,表明脂酰部分是铜结合所必需的。
铜诱导的死亡机制与铜稳态失调的遗传模型相同;研究人员构建了威尔逊氏病的小鼠模型,其中Atp7b缺失导致细胞内铜积累随着动物年龄的增加而导致细胞死亡。将老年Atp7b缺陷(Atp7b-/-)小鼠的肝脏与Atp7b杂合子(Atp7b-/+)和野生型对照小鼠的肝脏进行比较,观察到脂酰化和 Fe-S 簇蛋白的丢失,以及Hsp70丰度增加。这些在铜毒性小鼠模型中的发现表明,铜过载导致的细胞效应与铜离子载体诱导的细胞效应相同。
研究人员通过利用多种死亡方式的诱导剂与抑制剂从多维度阐明了铜离子诱导的细胞死亡是一种新型细胞死亡即铜死亡。表明过量的铜促进脂酰化蛋白质的聚集和 Fe-S 簇蛋白的不稳定,导致蛋白质毒性应激并最终导致细胞死亡— “铜死亡” (Cuproptosis)