2022年5月25日,来自美国福克斯切斯癌症中心Siddharth Balachandran、俄罗斯国立高等经济大学Alan Herbert等研究人员合作在《自然》杂志上发表了题为“ADAR1 masks the cancer immunotherapeutic promise of ZBP1-driven necroptosis.”的研究文章,发现ADAR1可阻止ZBP1驱动的坏死性凋亡。
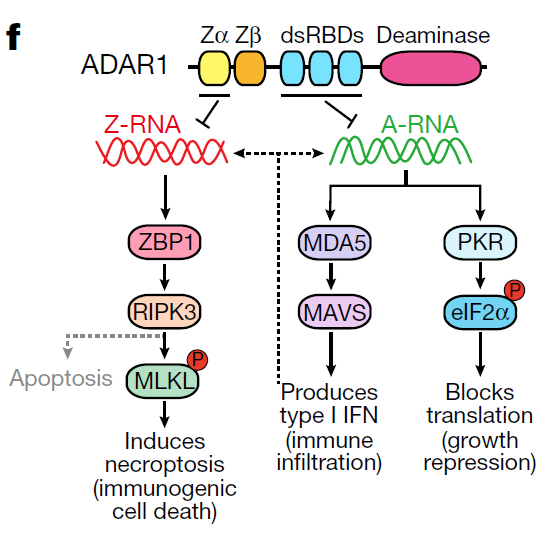
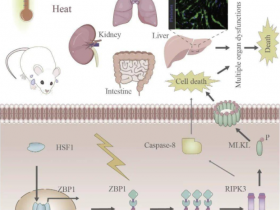
fig 1|ADAR1抑制内源性A-RNA和Z-RNA,以防止下游受体被激活。
研究人员表示,只有一小部分癌症患者对基于免疫检查点阻断(ICB)的单项疗法有持久的反应。RNA编辑酶ADAR1是一个新出现的决定性因素,它通过抑制免疫原性双链RNA(dsRNA),如那些由内源性逆转录病毒元件(ERE)表达失调而产生的双链RNA来防止ICB反应。这些dsRNA通过激活A型dsRNA(A-RNA)感应蛋白,如MDA-5和PKR5,引发干扰素依赖性抗肿瘤反应。
研究人员发现,ADAR1也阻止了内源性Z型dsRNA元件(Z-RNA)的累积,这些元件在干扰素刺激的mRNA的3′非翻译区富集。ADAR1的耗尽或突变导致Z-RNA的积累和Z-RNA传感器ZBP1的激活,最终导致了RIPK3介导的坏死性凋亡。由于目前没有临床上可行的ADAR1抑制剂,研究人员寻找了一种能推翻对ADAR1抑制要求并直接激活ZBP1的化合物。研究人员发现了一种小分子,即curaxin CBL0137,它通过触发细胞中的Z-DNA形成来有效地激活ZBP1。CBL0137在癌症相关的成纤维细胞中诱导ZBP1依赖性的坏死性凋亡,并在黑色素瘤的小鼠模型中逆转了ICB的无反应性。
总之,这些结果表明,ADAR1抑制内源性Z-RNA,并确定ZBP1介导的坏死性凋亡是被ADAR1掩盖的肿瘤免疫原性的一个新决定因素。ZBP1诱导的坏死性凋亡的治疗性激活为重启ICB抗性人类癌症的免疫反应性,提供了一个容易转化的途径。
(评论:这项研究找到的小分子药物curaxin CBLO137,已经在其他研究中进入临床试验,并在1期临床试验中被证明是安全的。有了这样的基础,也就意味着,后续有望更快地验证这种药物是否可以在癌症治疗中发挥作用。
)
文章来源:
Zhang, Ting, Yin, Chaoran et al,ADAR1 masks the cancer immunotherapeutic promise of ZBP1-driven necroptosis.DOI: 10.1038/s41586-022-04753-7,最新IF:43.07
2、《科学》:无线身体集成生物可吸收起搏器
2022年5月27日,来自美国西北大学John A. Rogers、Igor R. Efimov和Rishi K. Arora研究组合作在在《科学》杂志上发表了题为“A transient, closed-loop network of wireless, body-integrated devices for autonomous electrotherapy. ”的研究成果,建立了一种用于自主电疗的无线、身体集成设备的瞬态闭环网络。
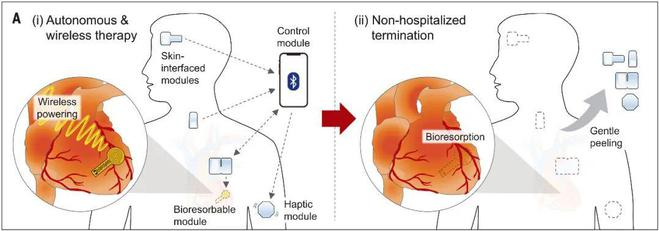
fig 2| 该系统在临时心脏起搏中的应用
他们提出了一个瞬态闭环系统,它将皮肤集成设备的时间同步无线网络与先进的生物可吸收起搏器相结合,以控制心律、跟踪心肺状态、提供多触觉反馈,并以最小的患者负荷实现瞬态操作。结果提供了一系列自主的、频率自适应的心脏起搏能力,如大鼠、犬和人类心脏研究中所证明的那样。这项工作为使用无线连接的身体集成生物电子设备的闭环临时电疗建立了一个工程框架。
据了解,临时术后心脏起搏需要带有经皮导线和外部有线电源和控制系统的设备。该硬件引入了感染风险、患者活动受限以及手术提取程序的要求。生物可吸收起搏器减少了其中一些缺点,但它们需要与外部有线系统和辅助控制机制配对。
(评论:这种皮肤界面装置在病人康复后可以很容易地移除。该系统为闭环技术提供了一个框架,以一种可以补充传统生物医学设备和药理学方法的方式治疗各种疾病和临时患者状况。)
文章来源:
A transient, closed-loop network of wireless, body-integrated devices for autonomous electrotherapy.DOI: abm1703,最新IF:41.037
3、《自然》:淋巴管转分化可产生专门的血管
2022年5月25日,来自以色列魏茨曼科学研究所Karina Yaniv、Rudra N. Das等研究人员合作在《自然》杂志上发表了题为“Generation of specialized blood vessels via lymphatic transdifferentiation.”的研究成果,发现淋巴管转分化可产生专门的血管。
据了解,细胞的谱系和发育轨迹是决定细胞身份的关键因素。在血管系统中,血液和淋巴管的EC通过分化和特化来满足每个器官的独特生理需求。虽然淋巴管被证明来自多种细胞来源,但LEC不知道会产生其他细胞类型。
研究人员利用斑马鱼臀鳍的循环成像和系谱追踪,从早期发育到成年,发现了一种通过淋巴管内皮细胞(LECs)的转分化形成专门血管的机制。此外,研究人员证明了从淋巴与血液内皮细胞(EC)衍生出的臀鳍血管在成年生物体中的功能差异,揭示了细胞本体和功能之间的联系。研究人员进一步利用单细胞RNA测序分析来描述了转分化过程中涉及的不同细胞群和过渡状态。
最后,结果表明,与正常发育相似,在臀鳍再生过程中,血管从淋巴管中重新衍生出来,表明成年鱼的LEC保留了生成血液EC的效力和可塑性。
(评论:这项研究强调了通过LEC转分化形成血管的先天机制,并为EC的细胞个体发生和功能之间的联系提供了体内证据。)
文章来源:
Yeon Sik Choi, Hyoyoung Jeong et al, Generation of specialized blood vessels via lymphatic transdifferentiation.DOI: 10.1038/s41586-022-04766-2,Nature:最新IF:43.07