1、Science:第三种嘌呤生物合成途径
2021年4月30日,来自法国巴斯德研究所Pierre Alexandre Kaminski团队在期刊《科学》发表了标题为“A third purine biosynthetic pathway encoded by aminoadenine-based viral DNA genomes”的研究结果,发现第三种嘌呤生物合成途径。
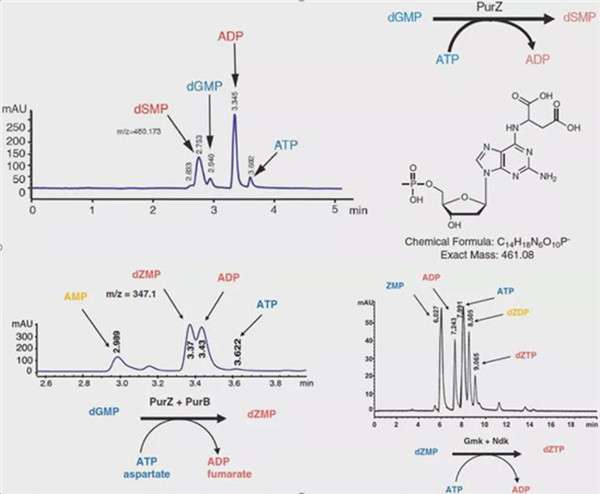
据研究人员介绍,细胞具有两种嘌呤途径,通过肌苷从磷酸核糖合成腺嘌呤和鸟嘌呤核糖核苷酸。腺嘌呤和鸟嘌呤之间的化学混合物2-氨基腺嘌呤(Z)取代了蓝细菌病毒(S-2L)DNA中的腺嘌呤。
研究人员发现,S-2L和弧菌噬菌体PhiVC8编码由PurZ催化的第三种嘌呤途径,一种琥珀酸腺苷酸合酶(PurA)的遥远旁系同源物,该酶在腺嘌呤途径中浓缩天冬氨酸和肌醇。PurZ将天门冬氨酸与脱氧鸟苷酸缩合成dSMP(N6-succino-2-amino-2′-deoxyadenylate),然后进行去富马酰化和磷酸化,得到dZTP(2-amino-2′-deoxyadenosine-5′-triphosphate),一种噬菌体DNA聚合酶的底物。晶体学和系统发育分析表明了噬菌体PurZ和古细菌PurA酶之间的密切关系。
(评论:这项工作阐明了生物催化的新方法,其重塑了超越常规分子生物学的DNA构建基块。)
文章来源:
Dona Sleiman, Pierre Simon Garcia et al, A third purine biosynthetic pathway encoded by aminoadenine-based viral DNA genomes. DOI: 10.1126/science.abe6494, Science:最新IF:41.037
2、《细胞》:剪接位点m6A甲基化通过阻止U2AF35结合从而抑制RNA剪接
2021年4月29日,来自瑞士日内瓦大学Ramesh S. Pillai、David Homolka研究组合作在《细胞》上发表了题为“Splice site m6A methylation prevents binding of U2AF35 to inhibit RNA splicing.”的一项新成果。发现剪接位点m6A甲基化通过阻止U2AF35结合从而抑制RNA剪接。
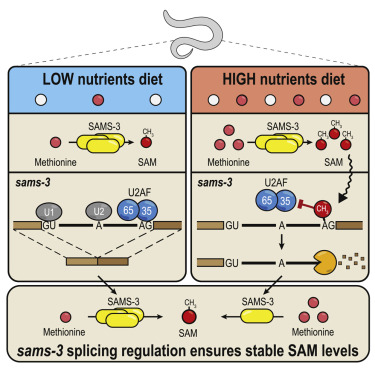
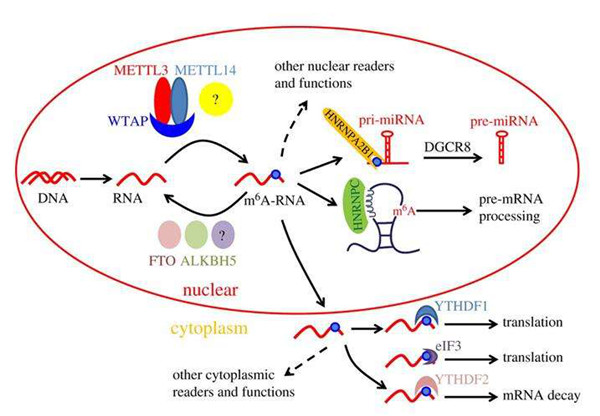
研究人员发现秀丽隐杆线虫RNA N6-甲基腺苷(m6A)修饰酶METT-10(小鼠METTL16的直系同源物) 通过对S-腺苷甲硫氨酸(SAM)合成酶pre-mRNA 3'剪接位点(AG)进行了m6A修饰,从而抑制了其正确剪接和蛋白质产生。
该机制由丰富饮食触发,并充当m6A的介导开关,以停止SAM的产生并调节其体内平衡。尽管哺乳动物SAM合成酶pre-mRNA不受此机制调控,但研究显示3'剪接位点m6A的剪接抑制在哺乳动物中也是保守的。该修饰通过阻止必需剪接因子U2AF35识别3'剪接位点而起作用。研究人员揭示了利用剪接位点m6A进行剪接调控的古老机制。
(评论:RNA m6A修饰可用于改变mRNA的命运。)
文章来源:
Mateusz Mendel, Kamila Delaney et al, Splice site m6A methylation prevents binding of U2AF35 to inhibit RNA splicing. DOI: 10.1016/j.cell.2021.03.062, Cell:最新IF:36.216
3、《细胞》: 揭示SARS-CoV-2中和抗体和合胞体调节的结构基础
2021年4月23日,来自新加坡科技研究局Cheng-I Wang等研究人员合作在《细胞》杂志上发表了题为“Structural insight into SARS-CoV-2 neutralizing antibodies and modulation of syncytia.”的相关论文,揭示SARS-CoV-2中和抗体和合胞体调节的结构基础。
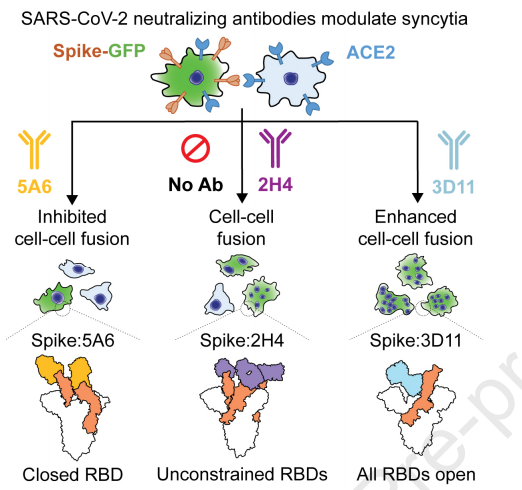
研究人员表示,SARS-CoV-2的感染是通过病毒突刺蛋白与宿主受体血管紧张素转化酶2(ACE2)结合而引发的,然后融合病毒膜和宿主膜。尽管阻断这种相互作用的抗体已被紧急用作早期的COVID-19治疗,但中和功效的确切决定因素仍然未知。
研究人员发现了一系列均能有效阻断ACE2结合的抗体,但它们对活病毒具有不同的中和功效。令人惊讶的是,这些中和抗体可以抑制或增强突刺介导的膜融合和合胞体的形成,这与COVID-19患者的慢性组织损伤有关。突刺-抗体复合物的多个冷冻电镜结构揭示了独特的结合模式,这些结合模式不仅阻断ACE2结合,而且还改变了ACE2结合触发的突刺蛋白构象循环。
(评论:不同突刺构象的稳定导致突刺介导的膜融合差异,这对COVID-19病理学和免疫力具有深远的影响。 )
文章来源:
Daniel Asarnow, Bei Wang et al, Structural insight into SARS-CoV-2 neutralizing antibodies and modulation of syncytia. DOI: 10.1016/j.cell.2021.04.033, Cell:最新IF:36.216