1、Science:徐彦辉研究团队揭示完整转录起始超级复合物结构与功能
2021年5月6日,来自上海复旦大学徐彦辉研究团队合作在学术期刊《科学》上发表了标题为“Structures of the human Mediator and Mediator-bound preinitiation complex.”的研究论文,解析出人类中介体和中介体结合的起始前复合物结构。
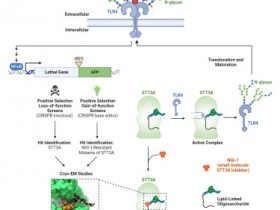
研究人员表示,1.3 MDa转录因子IID(TFIID)是起始前复合物(PIC)组装和几乎所有基因上RNA聚合酶II(Pol II)介导的转录起始所必需的。26个亚基的中介体促进转录和细胞周期蛋白依赖性激酶7(CDK7)介导的Pol II C末端域(CTD)磷酸化。
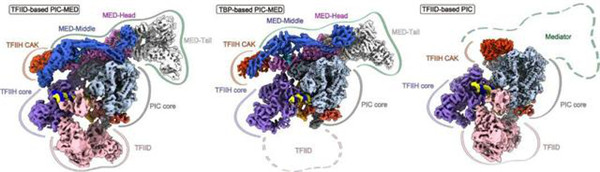
Fig 1|26个Mediator亚基进行完全定位和建模
研究人员确定了人类中介体的结构在扩展的尾巴模块(近原子分辨率)和弯曲的尾巴构象以及基于TFIID的PIC中介体(76个多肽,?4.1 MDa)在四个不同的构象中的结构。PIC-中介体组装引起中介体的协调重组,并产生头部-中部的三明治结构,这能够稳定两个CTD片段并将CTD带入CDK7进行磷酸化,从而提示CTD门控机制有利于磷酸化。基于TFIID的PIC体系结构可调节中介体的组织和TFIIH的稳定性,从而突出了TFIID在介导PIC-中介体组装中的重要性。
(评论:该项工作提供了具有生理相关性和功能完整性的PIC-Mediator复合物结构,揭示了完整PIC-Mediator复合物的动态组装过程,提出了Mediator调控Pol II CTD磷酸化可能的分子机制。结构及其所提示的功能关联性对后续转录机制研究具有重要的指导意义,将分子生物学领域相关研究推到了一个新的高度。)
来源:
Xizi Chen, Xiaotong Yin et al,Structures of the human Mediator and Mediator-bound preinitiation complex. DOI: 10.1126/science.abg0635, Science,最新IF:41.037
2、Nature Immunology:解析自然杀伤细胞中的全局性细胞因子信号网络
2021年4月15日,来自美国斯隆凯特琳癌症研究中心Colleen M. Lau、Joseph C. Sun等研究人员合作在《自然—免疫学》杂志上发表了题为“Deconvoluting global cytokine signaling networks in natural killer cells.”的论文,解析自然杀伤细胞中的全局性细胞因子信号网络。
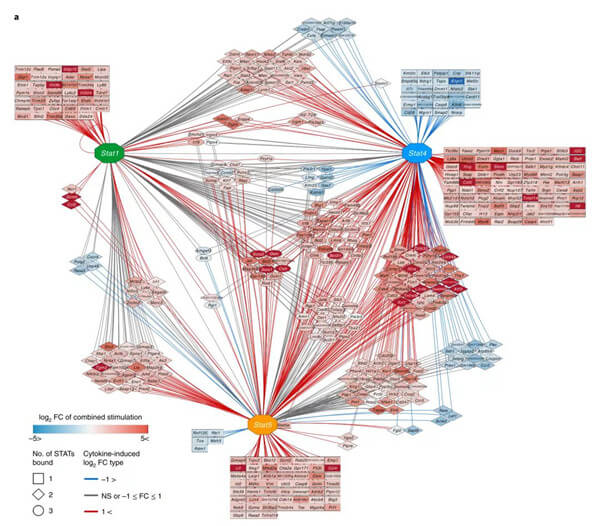
Fig 2|细胞因子及STAT相互作用网络
研究人员采用了一种多组学方法来解构和重建自然杀伤(NK)细胞中多个细胞因子信号通路的复杂相互作用。促炎细胞因子和稳态细胞因子形成一个共同的信号轴,共同调节整体基因表达并进一步抑制由I型干扰素信号传导诱导的表达。这些细胞因子通过STAT蛋白介导表观遗传调控的不同模式,并且集体信号传导最能概括全局性抗病毒反应。响应最活跃的基因在人类和小鼠之间都很保守,其中包括细胞因子STAT诱导的交叉调控程序。因此,在控制NK细胞应答的细胞因子信号传导途径之间存在复杂的串扰。
据悉,通过STAT蛋白的细胞因子信号传导对于NK细胞的最佳抗病毒反应至关重要。但是,细胞因子和STAT信号均具有多效性,因此无法将分子变化精确地归因于特定的细胞因子STAT模块。
(评论:通过STAT蛋白的细胞因子信号传导对于NK细胞的最佳抗病毒反应至关重要。此研究提供了重要资源和思路,可以指导定向实验并扩大人们对细胞因子信号传导的理解。这些转录和表观遗传学谱具有补充基础研究和翻译研究的潜力,推动我们实现更安全,更有效的免疫疗法。)
来源:
Gabriela M. Wiedemann, Deconvoluting global cytokine signaling networks in natural killer cells, DOI: 10.1038/s41590-021-00909-1, Nature Immunology:最新IF:23.53
3、Cell:首次全面揭示珊瑚生长的整个生命周期
2021年5月3日,来自西班牙巴塞罗那理工学院Arnau Sebé-Pedrós、以色列海法大学Tali Mass等研究人员合作在《细胞》杂志上发表了题为“A stony coral cell atlas illuminates the molecular and cellular basis of coral symbiosis, calcification, and immunity.”得研究论文,揭示珊瑚共生、钙化和免疫的分子和细胞基础。
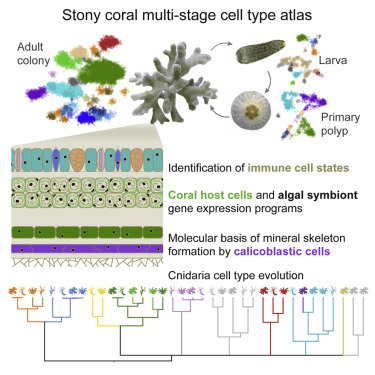
使用单细胞RNA测序,研究人员定义了柱状珊瑚(Stylophora pistillata)整个生命周期中的40多种细胞类型。研究人员发现了专门的免疫细胞,并发现了碳酸钙骨架形成的发育基因表达动态。通过同时测量珊瑚细胞和其中的藻类的转录组,研究人员表征了两个物种中共生相关的代谢程序。研究人员还通过系统发育整合了多种刺胞动物类型图谱来追踪这些珊瑚细胞分化的演化过程。总的来说,这项研究揭示了石质珊瑚生物学的分子和细胞基础。
(评论:石质珊瑚是群居的刺胞动物,它们维持着地球上生物多样性最强的海洋生态系统——珊瑚礁。 尽管它们具有生态重要性,但对于支撑珊瑚礁珊瑚生物学的细胞类型和分子途径知之甚少。 )
来源:
Shani Levy, Anamaria Elek et al, A stony coral cell atlas illuminates the molecular and cellular basis of coral symbiosis, calcification, and immunity. DOI: 10.1016/j.cell.2021.04.005