1、Cancer Cell:胰腺癌细胞产生的I型胶原蛋白Col1同源三聚体具有促癌特性。
2022年7月21日,来自美国德克萨斯大学MD安德森癌症中心Raghu Kalluri团队在《癌细胞》杂志上发表了标题为“Oncogenic collagen I homotrimers from cancer cells bind to α3β1 integrin and impact tumor microbiome and immunity to promote pancreatic cancer.”的研究成果,发现来自癌细胞的致癌胶原蛋白I同源三聚体与α3β1整合素结合,并影响肿瘤微生物组和免疫以促进胰腺癌。
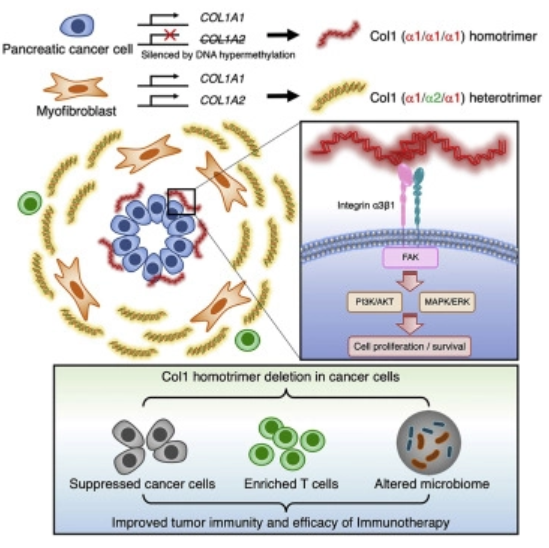
fig1|概图(来源Cancer Cell)
与成纤维细胞产生的正常I型胶原蛋白(Col1)异源三聚体(α1/α2/α1)相比,胰腺癌细胞特异性地产生独特的Col1同源三聚体(α1/α1/α1)。Col1同源三聚体由Col1a2基因的表观遗传抑制产生,并通过癌细胞上的α3β1整合素促进致癌信号传导、癌细胞增殖、肿瘤类器官形成和生长,这与缺氧和免疫抑制肿瘤中富含厌氧拟杆菌的肿瘤微生物组相关。
Col1同源三聚体的缺失增加了胰腺导管腺癌(PDAC)小鼠的总体存活率,这与肿瘤微生物组的重新编程与增加的微嗜氧弯曲杆菌有关,这可以通过广谱抗生素逆转。Col1同源三聚体的缺失增强了T细胞浸润并使抗PD-1免疫疗法的功效成为可能。本研究确定了Col1同源三聚体对肿瘤微生物组和肿瘤免疫的功能影响,表明Col1同源三聚体-α3β1整合素信号轴是癌症特异性治疗靶点。
Highlights
•Col1 produced by pancreatic cancer cells is the oncogenic homotrimer variant
•Col1 homotrimer deletion in cancer cells inhibits pancreatic tumor progression
•Col1 homotrimer deletion enriches T cells and beneficial tumor microbiome
•Col1 homotrimer deletion enables the efficacy of anti-PD-1 immunotherapy
(评论:首次系统的证实了胰腺癌中肿瘤细胞和成纤维细胞各自合成的Col1,具有完全不同的生化结构和生物学功能,揭示了目前针对癌症相关成纤维细胞或胞外基质成分为直接靶点的临床实验失败的可能原因,为进一步制定新的治疗策略,筛选新的治疗靶点提供理论依据。)
文章来源:
Yang Chen, Sujuan Yang, Jena Tavormina et al,Oncogenic collagen I homotrimers from cancer cells bind to α3β1 integrin and impact tumor microbiome and immunity to promote pancreatic cancer.DOI: 10.1016/j.ccell.2022.06.011,Cancer Cell:最新IF:23.916
2、Nature Biotechnology:开发出增强蛋白质产生的环状RNA
2022年7月18日,来自美国斯坦福大学Howard Y. Chang研究团队在《自然—生物技术》杂志上发表了标题为“Engineering circular RNA for enhanced protein production.”的研究成果,开发出增强蛋白质产生的环状RNA。
据悉,circRNA是真核细胞中稳定而普遍的RNA,由反向拼接产生。合成的circRNA和一些内源性circRNA可以编码蛋白质,提高了circRNA作为基因表达平台的前景。
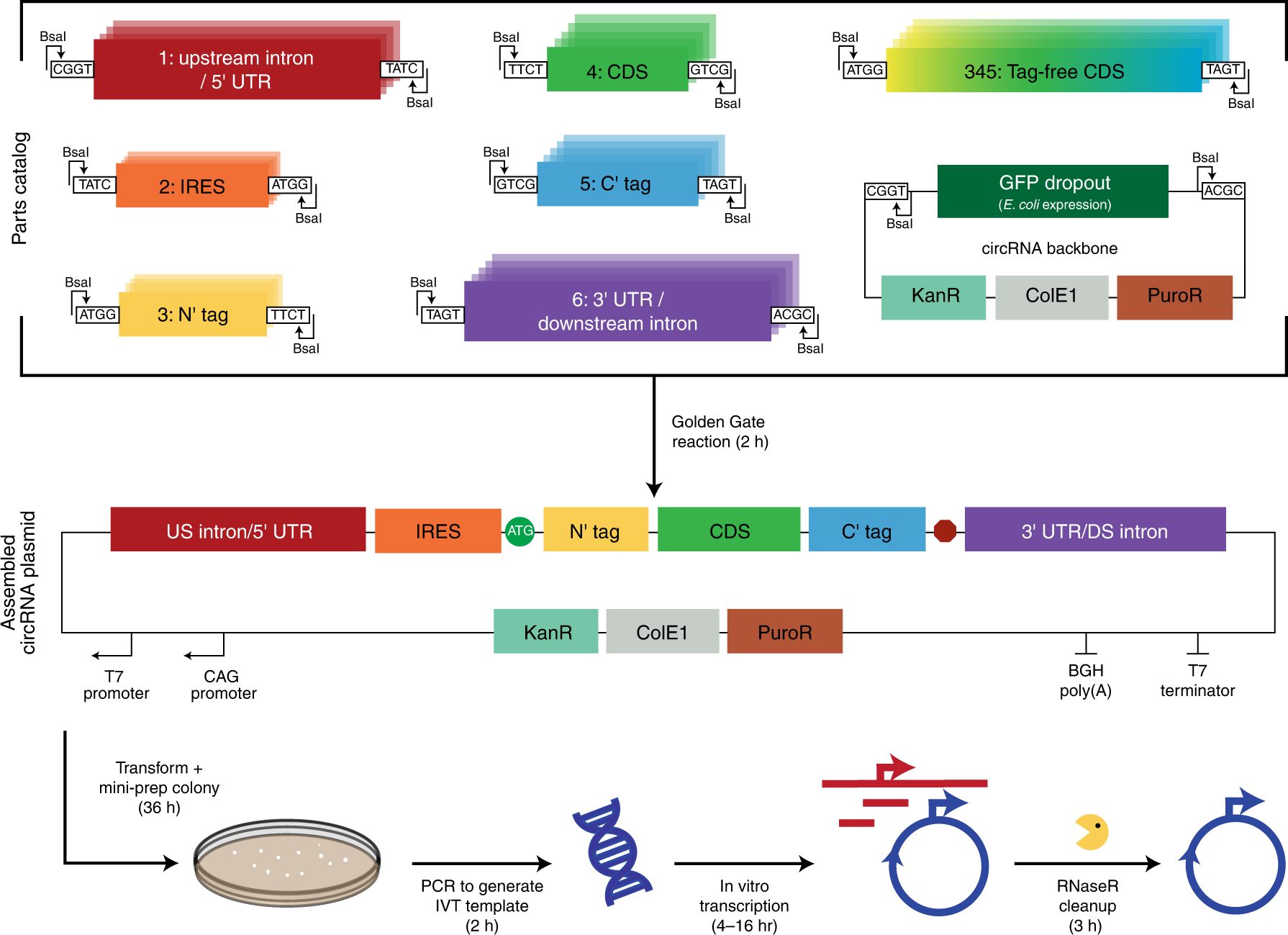
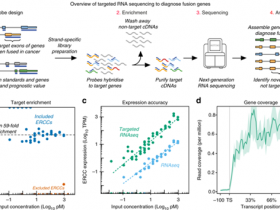
fig 2| 用于 circRNA 的模块化克隆平台可实现快速的设计-构建-测试周期
研究人员开发了一种系统的方法,用于快速组装和测试影响合成环状RNA(circRNA)蛋白生产的特征。为了最大限度地提高circRNA的翻译,研究人员优化了五个要素:载体拓扑结构、5′和3′非翻译区、内部核糖体进入位点和招募翻译启动机器的合成适配子。这些设计原则结合在一起,使circRNA的蛋白质产量提高了几百倍,在体外提供了比信使RNA更多的翻译,在体内提供了更持久的翻译,并可在多个转基因中通用。
(评论:通过一系列工程化技术手段将 circRNA 蛋白质产量提高了数百倍,为今后的产业化应用提供了一种新的途径。)
文章来源:
Chen, Robert, Wang, Sean K. et al, Engineering circular RNA for enhanced protein production.
DOI: 10.1038/s41587-022-01393-0,Nature Biotechnology:最新IF:31.864
3、Science:深度学习构建蛋白质功能位点
2022年7月22日,来自美国华盛顿大学David Baker和哈佛大学Sergey Ovchinnikov小组合作在在《科学》杂志上发表了标题为“Scaffolding protein functional sites using deep learning.”得研究成果。研究利用深度学习构建蛋白质功能位点。
据悉,蛋白质的结合和催化功能通常由整个蛋白质序列中少量功能残基决定的。
研究人员研发了用于揭示蛋白质功能位点的深度学习方法,并且无需预先设定蛋白质的折叠或二级结构。第一种方法“constrained hallucination”,优化序列,使其预测结构包含所需的功能位点。 第二种方法,“修复”,从功能位点开始,填充额外的序列和结构,利用经过专门训练的RoseTTAFold网络在单次前向传递中创建可行的蛋白质支架。研究人员使用这两种方法来设计候选免疫原、受体陷阱、金属蛋白、酶和蛋白质结合蛋白,并结合使用计算机和实验测试来验证设计。
文章来源:
Science:Jue Wang, Sidney Lisanza et al, Scaffolding protein functional sites using deep learning.DOI: abn2100,Science:最新IF:41.037