1、Nature:人类造血干细胞发育路线图
2022年4月13日,来自美国加州大学洛杉矶分校Hanna K. A. Mikkola、Vincenzo Calvanese等研究人员合作在《自然》杂志上发表了题为“Mapping human haematopoietic stem cells from haemogenic endothelium to birth.”的研究成果,绘制出人类造血干细胞从造血内皮到出生的图谱。
据了解,由于无法确定造血干细胞在不同造血部位出现和成熟时的情况,因此人类HSC的发育过程界定得很差。
(体外生成 AGM 样造血干细胞和祖细胞(HSPC))
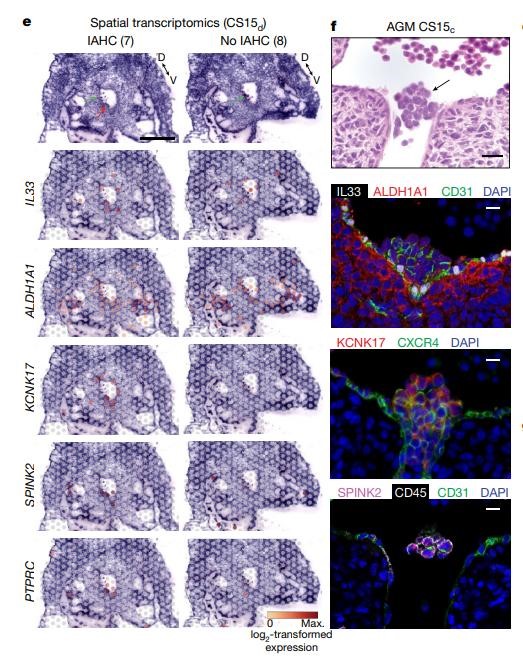
研究人员创建了一个人类造血组织的单细胞转录组图,从最早的妊娠到出生,并发现造血干细胞(HSC)特征RUNX1+HOXA9+MLLT3+MECOM+HLF+SPINK2+在整个妊娠期将HSC与祖先区分开来。除了主动脉-性腺-脾脏区域外,新生的HSC在6周时定植于肝脏之前,还在胎盘和卵黄囊中繁殖。对不同成熟阶段的HSC进行比较,研究人员发现HSC的转录因子机器是在HSC出现后建立的,而它们的表面表型在整个发育过程中不断变化。HSC向肝脏的过渡标志着一种分子转变,反映新生HSC身份的表面抗原被抑制,并获得了HSC的成熟标志CD133(由PROM1编码)和HLA-DR。HSC的起源被追踪到ALDH1A1+KCNK17+成血内皮细胞,该细胞来自IL33+ALDH1A1+动脉内皮亚群,称为成血前内皮细胞。
利用空间转录组学和免疫荧光,研究人员在位于腹腔的主动脉内造血细胞群中看到了这一过程。人类HSC发育图谱验证了从人类多能干细胞中产生的类似于主动脉-性腺-肾脏的确定性HSC和祖细胞,并作为改善其成熟为功能性HSC的指南。
(评论:这一研究成果将有助于了解造血干细胞和造血祖细胞之间的根本差异,这对于创造适合用于移植疗法的细胞至关重要。)
文章来源:
Calvanese, Vincenzo, Capellera-Garcia et al, Mapping human haematopoietic stem cells from haemogenic endothelium to birth. Nature: DOI: 10.1038/s41586-022-04571-x
2、Nature:CAR-T细胞杀伤力在实体瘤中需要IFNγR途径
2022年4月13日,来自美国马萨诸塞州综合医院Marcela V. Maus研究团队在学术期刊《自然》上发表了标题为“CAR T cell killing requires the IFNγR pathway in solid but not liquid tumours.”的研究论文,发现CAR T细胞杀伤力在实体瘤中需要IFNγR途径。
为了以无偏见的方式系统地识别潜在的抗性途径,研究人员在胶质母细胞瘤中进行了全基因组CRISPR敲除筛选,在这种疾病中,嵌合抗原受体(CAR)T细胞的疗效有限。研究人员发现,干扰素-γ受体(IFNγR)信号通路(IFNGR1、JAK1或JAK2)的基因缺失使胶质母细胞瘤和其他实体瘤在体外和体内都对CAR T细胞的杀伤力更强。然而,这一途径的丧失并没有使白血病或淋巴瘤细胞系对CAR T细胞不敏感。
据悉,CAR疗法对血液学恶性肿瘤的治疗产生了变革性影响,但它对实体瘤的疗效有限。实体瘤可能对CAR T细胞的细胞毒性具有细胞内在的抵抗机制。
通过转录分析,研究人员确定缺乏IFNγR1的胶质母细胞瘤细胞在暴露于CAR T细胞后,细胞粘附途径的上调率较低。研究人员发现胶质母细胞瘤细胞中IFNγR1的缺失降低了CAR T细胞的整体结合时间和亲和力。鉴于CAR T细胞不需要传统的抗原呈递途径,IFNγR信号在实体瘤对CAR T细胞的易感性方面的关键作用令人惊讶。相反,在胶质母细胞瘤中,IFNγR信号是CAR T细胞充分粘附以介导生产性细胞毒性的必要条件。
这项工作表明,非实体瘤和实体瘤与CAR T细胞的相互作用是不同的,并表明加强T细胞和肿瘤细胞之间的结合相互作用可能会改善实体肿瘤的反应。
文章来源:
Larson, Rebecca C., Kann et al, CAR T cell killing requires the IFNγR pathway in solid but not liquid tumours,DOI: 10.1038/s41586-022-04585-5, Nature:最新IF:43.07
3、Nature:HIV-1抗体治疗可延长病毒抑制的时间
2022年4月13日,来自美国洛克菲勒大学Michel C. Nussenzweig、Marina Caskey等研究人员合作在国际学术期刊《自然》上发表了题为“Prolonged viral suppression with anti-HIV-1 antibody therapy”的研究论文,发现HIV-1抗体治疗可延长病毒抑制的时间。
研究人员报告了一项临床研究,在有或没有抗逆转录病毒疗法的情况下,HIV感染者在20周内接受了7个剂量的两种广泛中和抗体的组合。在没有预先筛选抗体敏感性的情况下,76%的志愿者(17人中的13人)在停止抗逆转录病毒疗法至少20周后仍保持病毒学抑制。事后敏感性分析对病毒反弹的时间没有预测作用。那些病毒保持抑制20周以上的人在其中一种抗体达到血清浓度低于10微克每毫升后出现了病毒反弹。在接受所有七个抗体剂量的人中,有两个人在一年后仍保持抑制。在抗体治疗6个月后进行的储库分析显示,完整的前病毒储库的大小和组成发生了变化。相比之下,这些人的缺陷库没有明显的减少。
这些数据表明,抗体的使用会影响HIV-1储库,但还需要进行更大规模和更长时间的研究来确定抗体免疫疗法对储库的确切影响。
据了解,HIV-1感染仍然是一个无法治愈的公共卫生问题。抗逆转录病毒疗法(ART)是有效的,但由于CD4+ T细胞的基因组中存在稳定的潜伏前病毒库,因此需要终身服药。HIV-1抗体的免疫疗法有可能抑制感染并提高感染细胞的清除率。
文章来源:
Gaebler, Christian, Nogueira et al, Prolonged viral suppression with anti-HIV-1 antibody therapy. DOI: 10.1038/s41586-022-04597-1, Nature:最新IF:43.07