抗原表位预测适用于已知一级结构的蛋白质或多肽抗原的线性表位的预测。人们通过观察抗原表位与已知氨基酸序列的蛋白质某些结构特征关系,发现一些蛋白质的序列或结构特征与抗原表位有关。从80年代Hopp和Woods提出亲水性参数对抗原表位预测的方法以来,已有许多参数、算法发表,对B细胞蛋白抗原表位研究起到巨大的推动作用。现已被大众认可并具有较好预测效果的方法,主要有以下6种:
(1)亲水性方案(Hydrophilicity)
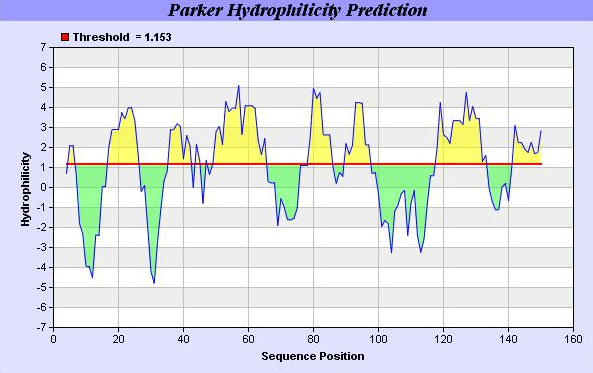
常用的有五种方法:Nozaki-Tanford scale,Hopp-Woods scale,Eisenberg scale,Kyte-Doolittle scale,HPLC scale。其中尤以Hopp-Woods方案最为有名。认为蛋白质抗原各氨基酸残基可分为亲水残基和疏水残基两类。在机体内,疏水性残基一般埋在蛋白内部,而亲水性残基位于表面,因此蛋白的亲水部位与蛋白抗原表位有密切的联系。Hopp-Woods方案是以残基由有机相环境转移到水相环境的自由能为依据计算各个氨基酸的亲水性。现已明确,亲水性部位与抗原表位并无很好的一致性,即高亲水性部位不一定是表位,表位也不一定是亲水性部位。
(2)可及性方案(Accessibility)
如Janin可及性参数,指蛋白质抗原中氨基酸残基被溶剂分子接触的可能性。它反映了蛋白质抗原内、外各层残基的分布情况。
(3)抗原性方案(Antigenicity)
对20个已研究得很透的蛋白质的69个连续位点的606个氨基酸统计分析,Welling建立了抗原性刻度。每个氨基酸用出现在抗原区的频率描述,此频率除以各氨基酸在所有蛋白质中的频率就可推出此刻度值。该法研究表明,疏水性氨基酸残基对抗原表位形成亦有贡献。缺点是其所用的数据库有限,并且连续位点内的残基被认为是同等重要的。显然那些不重要的残基归入计算会明显降低相关性。
(4)可塑性方案(Flexibility)
指蛋白抗原构象不是刚性不变的,其多肽链骨架有一定程度的活动性,活动性强的氨基酸残基即可塑性大的位点,易形成抗原表位。Karplas 和Schulz基于已知结构的31个蛋白质的Cx的温度β因子,发展了一种预测蛋白质片段活动性的方法。
(5)电荷分布方案(Charge distribution)
认为对碱性抗原特异的抗体多趋于酸性,对酸性抗原特异的抗体多趋于碱性。
(6)二级结构预测方案(Secondary structure)
认为β转角结构为凸出结构,多出现在蛋白质抗原表面,利于与抗体嵌合,较可能成为抗原表位。而α螺旋、β片层结构规则不易形变,较难嵌和抗体,一般不作为抗原表位。可预测蛋白质β转角的有Chou-Fasman,Garnier,Cohen等方法。其中各种方法预测的成功率均不超过65%。一般认为Cohen方法对转角的预测正确率很高,对于已知折叠类型的蛋白质(αα类,ββ类,α/β类)正确率高达95%,对于未知结构类型的蛋白质,可用3种类型分别预测,3类预测一致的转角对预测表位有帮助。
对上述各种参数的预测比较表明,各种方案预测的正确率均不高。一般将上述多种方案综合考虑,尤以可及性方案、可塑性方案、抗原性方案及二级结构预测为重要。概括而言,作为B细胞蛋白抗原的表位首先应易于位于或移动于蛋白质抗原表面,有利于与抗体结合。另外,具有一定柔韧性,因为抗原与抗体结合时蛋白构象有一定的变化。已经有一些文献提出了各自不同的综合分析方法。1988年Jameson和Worf提出一种综合预测方案。权重选择为:40%来自二级结构成分,可及性、柔韧性各15%,30%来自亲水性。在吴加金等编的Goldkey软件中,以六种参数Hopp-Woods,HPLC,Accessibility,Flexibility,Charge,Antigenivity综合考虑,得出综合判断图,阈值以上的峰即认为是预测的抗原表位。