综述
在此,我们报道了4’-c-三氟甲基(4’-CF3)胸苷(T4’-CF3)的合成及其通过固体支持的DNA合成并入寡脱氧核苷酸(ODNs)。4’-CF3修饰对脱氧核糖构象产生边际影响,并对ODN/RNA双链产生局部螺旋结构扰动。这种类型的修饰略微降低了ODN/RNA双链的热稳定性(-1°C/修饰),并导致提高了核酸酶的抗性。与众所周知的硫代磷酸酯(PS)改性一样,4’-CF3的重改性可以在不使用任何传递试剂的情况下使细胞直接摄取改性的ODNs。这项工作强调了4’-CF3修饰的ODN是基于反义疗法的有前途的候选者,这反过来将激励我们开发更有效的反义ODNs和siRNAs修饰。
介绍
反义寡核苷酸(ODNs)和小干扰RNA(siRNAs)是一类有前途的治疗分子,通过沃森-克里克碱基配对靶向互补RNA,具有很高的亲和力和特异性。然而,由于天然寡核苷酸的细胞通透性和核酸酶易感性较差,因此它们不是类药物分子。因此,已经开发出许多不同类型的修饰来改善这些基于寡核苷酸的药物分子的药动学和药效学特性。尽管迄今为止报道的大多数化学修饰都能增强核酸酶的抗性和靶亲和力,但很少有化学修饰能提高细胞的通透性。例如,硫代磷酸酯(PS)骨架是少数能促进ODNs细胞摄取的修饰物之一,已被应用于几乎所有市面上销售的反义ODN药物中。细胞对PS修饰的ODNs的摄取尚不完全了解,但增加了细胞对ODNs的吸收。PS主干的持久性被认为是非常重要的。
氟是电负性最强的元素,使碳-氟键极性强,不活泼。然而,c-f键可以通过偶极和静电相互作用与其他官能团或分子相互作用。在药物分子中引入氟原子会对其亲脂性、构象和代谢稳定性产生不同的影响,从而导致更好的生物利用度、更高的靶特异性和更低的有效剂量。许多有机氟化合物和氟改性寡核苷酸已在药物开发中合成。近年来,全氟烷基链与ODNs的5′-端结合已被证实增加了亲脂性,从而增强了细胞的通透性。结果表明,荧光改性是制备具有良好细胞通透性的ODNs的一种有希望的方法。
相对于其他位置而言,对核苷(T)侧C4′的修饰是相当困难的,但可能具有显著的性质。首先,在双相形成时,C4′取代位于小沟的边缘,不会显著影响杂化性质。螺旋构造。第二,C4′取代可以通过空间延迟核酸酶与两个相邻的磷酸二酯键的结合来赋予核酸酶抗性。第三,一些C4′取代可以通过电荷-cha调节相邻的磷酸二酯键的物理和化学性质。RGE/偶极相互作用、盐/水桥等导致细胞摄取增强。到目前为止,合成C4′修饰的反义ODNs/siRNAs并评价其基因沉默活性已引起广泛关注。
三氟甲基(CF3)取代基在医药化学中应用广泛。CF3组的空间需求量与异丙基组相似。用CF3取代氢原子可使亲脂性增加+0.88,促进细胞吸收和生物分布。在此背景下,我们推测,将一个cf3基团引入到核苷酸的C4'位置,一方面可能增加磷酸-糖骨架的亲脂性,并使修饰的ODN能够直接被细胞吸收,另一方面由于该酶的作用,提高了对核酸酶的抗性。IC冲突。Johnson等人成功地合成了4′-C-三氟甲基(4′-CF3)核苷类似物。通过相当长的合成路线(超过10个步骤),以开发有效的抗病毒剂。
本文报道了一种合成4′-CF3胸腺嘧啶(T4′-CF3)的更简洁的方法。此外,我们首次将T4′-CF3加入到ODN中,并对其生物物理和生化特性进行了研究。正如我们预期的那样,4′-CF3的大量修饰大大增加了核酸酶的抵抗力,并使细胞能够直接摄取修饰的ODNs。
结果与讨论
从已知化合物1.37开始合成4′-CF3胸苷(图1),在C4羟基氧化成酮后,用CF3Time3引入三氟甲基,然后用TBAF处理,得到一对非对映异构体3a和3b。无构型。在C4可以在这个阶段确定。这些在转化为核苷后得到证实(见下文)。以副异构体形式获得所需产物3a。
3a二硫醚基团的氧化裂解产生C4-CF3取代的脱氧核糖。39在将羟基保护为乙酸盐后,对所得4进行改良的伏尔布鲁根反应,得到4′-CF3α-D-核糖呋喃基胸腺嘧啶5a和4′-CF3β-D-核糖呋喃基胸腺嘧啶。Ymine 5b的产量几乎相等。5a/5b的c4′和c1′处的结构通过核大修效应(NOE)实验确认。在甲醇中用pdcl2/h2对纯同分异构体5b进行脱苄,得到收率为82%的T4′-CF3,经过两个常规步骤转化为磷酰胺。
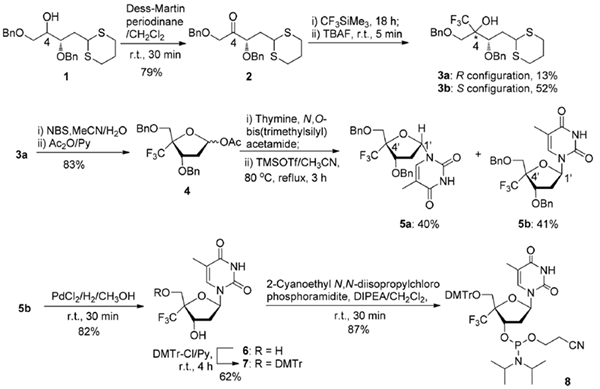
图1 4’-CF3胸苷合成亚磷酰胺的技术路线
核糖核酸酶h1(RNase h1)选择性地水解RNA/DNA双链的RNA链,因此RNase h1招募是反义基因沉默的首选性质。RNase h1与RNA/DNA双链的结合对螺旋结构特别是小凹槽的宽度高度敏感。46因此,通过ODN 1–5/RNA双链的RNase h1足迹来评估由4′-CF3修饰引起的螺旋结构变化。如图2所示,4′-CF3修饰导致大约4 bp的拉伸,从修饰位置开始向ODN链的5′端延伸,抵抗RNase H1裂解(图2)。这一结果证实了4′-CF3的修饰导致了双螺旋结构的局部变化。因此,为了设计4’-CF3修饰的antisense ODNs,通过RNA酶H1诱导RNA降解的能力,在中间引入4个或更大的未修饰的DNA核苷酸的间隙。
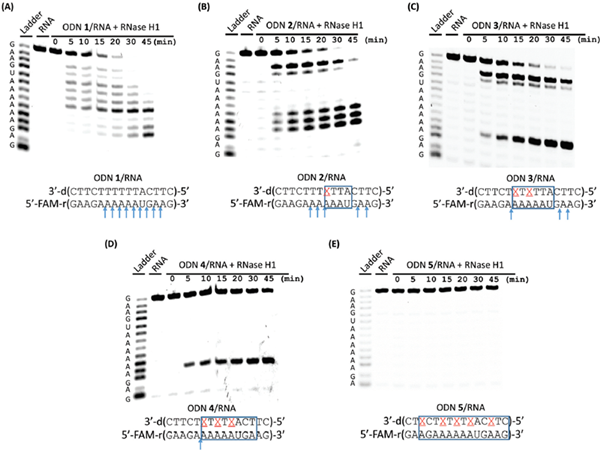
图2 RNase h1促进ODN/RNA双链的裂解模式
为了评价4’-CF3修饰对核酸酶抗性的影响,在人血清中孵育5’-FAM标记的ODNS 6 - 8(图3A)。24小时后,天然的ODN6完全降解(图3b),而含有5种T4′-CF3修饰的ODN8显示出显著的稳定性改善,大约50%保持完整。ODN 7的血清稳定性介于两者之间。因此,ODN中的4′-CF3修饰导致对核酸酶的抗性大大增强。
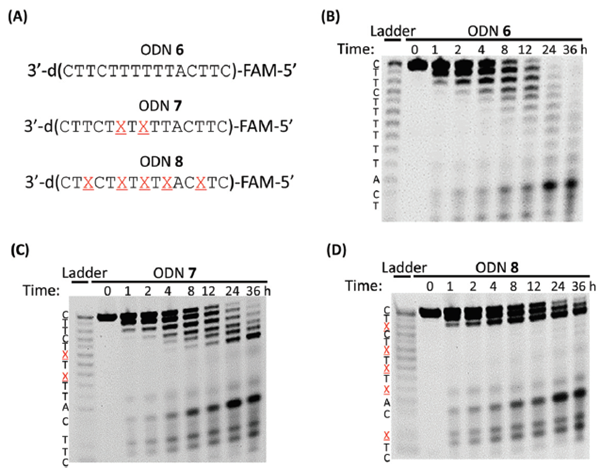
图3 经4 ' -CF3修饰的人血清ODNs降解20%变性PAGE分析
最后,利用流式细胞仪和共聚焦荧光显微镜对ODNs 6-8的通透性进行了检测。HELA细胞在含有FAM标记的ODN6-8的MEM选择培养基中培养6小时。流式细胞术对培养细胞的分析显示,2%、3%和11%的细胞分别是用ODN 6、ODN 7和ODN 8培养的荧光细胞(图4a)。尽管细胞直接吞噬ODN 8的效率不如天然ODN 6的脂质体递送效率高,但这些结果证实,4′-CF3修饰可提高ODNs的细胞通透性,细胞摄取效率在细胞内升高,而且还会增加T4′-CF3修饰的数量。这启发我们合成一个更大程度上修改的ODN9,并检查其细胞吸收效率。ODN 9是一个10-低聚物dt,中间含有八个连续的t4′-cf3修饰(图4b)。在不使用任何传递试剂的情况下,培养的Hela细胞吸收了16%的ODN9,与预期一样,明显高于ODN8。
作为对照组,我们也检测了ODN10和11的细胞摄取情况,这两个基因序列与ODN 9相同,但分别含有8个连续的PS键和2’-脱氧-2’-氟尿苷(dU2’-f)修饰。在相同的条件下,经PS修饰的ODN 10被42%的处理细胞吸收,而经dU2′-f修饰的ODN 11没有表现出明显的细胞吸收(2%)。因此,T4′-CF3修饰的ODN的直接细胞摄取不如PS修饰的ODN,而是比2′-F修饰的ODN好得多。与4′-CF3相比,2′-F的亲脂性较低,且相对远离磷酸二酯键。4′-CF3与2′-F修饰的ODN的细胞通透性完全不同,说明亲脂性4′-CF3与磷酸键的相互作用是提高细胞通透性的关键。
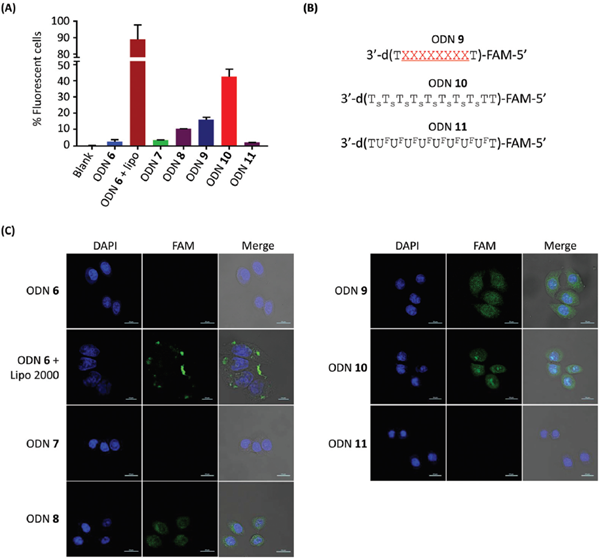
图4 ODNs.的细胞吞噬作用
结论
总之,我们成功地合成了4′-CF3胸苷,并将其引入到基于DNA合成的ODNs的固相载体中。一个4′-CF3修饰导致对ODN/RNA双链的轻微失稳效应(-1°C/修饰),但增加了核酸酶抵抗。显著的是,4′-CF3修饰提高了ODNs的细胞通透性,并且观察到4′-CF3修饰的数量与细胞吸收效率呈正相关。4′-CF3修饰的ODNs进入细胞后,其胞内分布与PS修饰的ODNs相似,表明它们可以通过相同的机制被细胞吸收。大量的4′-CF3修饰引起了ODN/RNA双链的局部结构扰动,导致了对RNase h1裂解的约4 bp的延伸。
在这种情况下,两端带有重C4′-CF3修饰的gapmer反义ODNs可能是治疗应用的理想选择。这项工作强调了4′-CF3修饰的ODN是基于反义疗法的有前途的候选者,这反过来将激励我们开发更有效的反义ODNs和siRNAs修饰。