综述
C反应蛋白(CRP)作为炎症的生物标志物被广泛应用。作为模式识别受体的一员,通过结合氧化特异性表位(包括脂质氧化链反应的一些中间产物)在先天免疫反应中发挥重要作用。CRP的抗氧化能力在体外的证据很少,特别是在体内需要进一步阐明。在此,我们在三种具有代表性的非动物有机体(大肠杆菌、酿酒酵母和烟草)中表达人CRP,这三种有机体天生缺乏CRP信号环境,并且发现CRP确实具有内在的抗氧化能力。异源CRP在重组大肠杆菌、酵母细胞和转基因烟草中具有增强的抗氧化能力。我们还发现,CRP的抗氧化作用与其溶解度呈正相关。只有可溶性CRP才能表现出明显的抗氧化活性,而CRP聚集物可能对细胞具有毒性(可能是氧化前)。此外,与高酸性小肽的融合可以显著提高CRP的溶解度,同时保证或提高CRP的抗氧化能力。这些结果不仅为了解与炎症和疾病有关的CRP病因提供了新的见解,而且认可了CRP生物技术在开发新的药物疗法和提高植物抗氧化能力方面的潜在应用。
背景
C反应蛋白(CRP)是人和动物体内高度保守的急性期蛋白,与氧化应激引起的大量炎症密切相关。在炎症过程中,循环中CRP水平在24-72小时内可急剧升高1000倍以上,几乎出现在各种炎症性病变中。因此,CRP已成为广泛使用的炎症标志物。此外,CRP被认为是许多心血管疾病(CVD)、年龄相关性黄斑变性(AMD)和阿尔茨海默病(AD)的不可忽视的危险因素/或介质。
CRP有两种构象亚型:天然五聚体PCRP和修饰/单体MCRP。PCRP包含五个相同的23kDa亚单位,作为环对称地围绕中心孔排列。在细胞膜/微泡诱导或经历其他转化机制后,PCRP可以与表现出非常不同功能的PCRP*或MCRP(M)的中间活性异构体分离成MCRP。这可能解释了CRP的双重但仍有争议的作用,即抗炎和促炎作用,其中MCRP和PCRP*被认为是促炎作用的主要参与者。在这一过程中,随着结构变化,蛋白质变得更加无序,β-片减少,α-螺旋增加。MCRP倾向于聚集成基质样的晶格结构,可能更倾向于沉积在组织膜上。例如,在正常人体组织的血管壁上自然检测到MCRP,并且在人动脉粥样硬化斑块、AMD德鲁森和β淀粉样斑块中也大量发现,这些斑块可能与其他聚集蛋白共存。
CRP能识别氧低密度脂蛋白和凋亡细胞,但不能识别非氧化低密度脂蛋白和活细胞。实际上,CRP是一种模式识别受体,属于先天免疫系统。活性氧是有氧代谢不可避免的副产物。过多的活性氧通常会产生氧化损伤的分子、复合物和细胞,这些分子、复合物和细胞必须被固有免疫系统的巨噬细胞和清除剂细胞处置。PRRs标记了先天免疫系统可获得的氧化损伤产物,即使死亡或损伤的细胞与活细胞不同。
通过活性氧攻击,在凋亡细胞表面出现一系列氧化特异表位(OSE),如氧化磷脂(OxPLS)和丙二醛(MDA)修饰加合物,被PRRS识别,从而参与凋亡细胞去除过程。膜的多不饱和脂肪酰链优先氧化在甘油主链的sn-2位置,生成大量截短的oxpls34,其中许多高活性的oxpl衍生物在其sn-2末端含有醛或羧酸等基团。位置。这些极性部分可能不再停留在低介电烃相内,并倾向于挤入相邻的水相35。oxpls优先组装在一起形成“补丁”,作为纳米传感器,被先天免疫系统的prrs识别。
氧化磷脂酰胆碱(OxPC)是CRP37的特异性模式识别配体。实际上,CRP通过识别它们共同的同源表位OxPC来结合OxLDL和凋亡细胞。每个CRP亚单位都有一个与OxPC结合的位点。磷脂酰胆碱(PC)是膜和脂蛋白上的主要脂质成分,在活性氧攻击下最容易氧化转化为氧代PC。CRP能结合多种OxPC物质,包括高活性的过氧自由基和作为脂质氧化链反应中间体的过氧化氢。这种作用可以保护活性氧代PC与未氧化的磷脂相互作用,从而阻止氧化链反应的进展,保护细胞免受氧化损伤,这意味着CRP可能具有内在的抗氧化能力。
然而,关于CRP的直接抗氧化活性的报道很少。只有两项体外研究表明,利用CRP的识别特性,CRP能在生理浓度下抑制低密度脂蛋白和磷脂脂质体的氧化。通常,识别功能被认为是CRP介导补体激活的必要条件,导致CRP的促炎作用及其相反的活性(如抗肺炎球菌、抗动脉粥样硬化、抗关节炎),主要在炎症性疾病的动物模型中观察到。SES。然而,这些保护作用都不是来自缺乏CRP信号通路的实验动物,因此不能绝对地单独指向CRP。因此,CRP是否具有内在的抗氧化作用的谜团仍有待澄清,尤其需要体内证据。在此,我们故意尝试验证异源CRP在几种非动物有机体(如大肠杆菌、酵母和内部缺乏CRP信号环境的高等植物)中的抗氧化作用。我们揭示了CRP确实具有固有的抗氧化能力,其在体内的实际效果是由其溶解性决定的。
结果
异源CRP增加了大肠杆菌的抗氧化能力。首先,我们扩增了人CRP成熟链的编码片段,构建了人CRP的原核表达载体pET(CRP)和含有一个不能结合磷酸胆碱的CRP(F66Y/E81K)突变体的衍生pET(CRPM)。然后将其导入大肠杆菌BL21(DE3)菌株中,通过预诱导大肠杆菌细胞的点镀试验,评价其在过氧化氢、百草枯(PQ)和硫酸铜三种常用氧化应激下的抗氧化能力。如图1A所示,所有被测大肠杆菌菌株的细胞生长在正常条件下(CK)相似,但在各种氧化应激下(1.1 mM H2O2、0.5 mM PQ和5 mM CuSO4)有不同的抑制作用。其中,重组pET(CRP)菌株的菌落状态明显优于pET30s对照菌株,通过0.5 mM pq和5 mM cuso4氧化胁迫下大肠杆菌生长动态曲线分析进一步证实了这一点。然而,重组大肠杆菌(CRPm)的菌落状态比pET(CRP)明显恶化,甚至与对照菌株相似(图1A)。这些结果表明,异源CRP介导了大肠杆菌抗氧化能力的增强,使细胞对氧化应激有更强的抵抗力,这一作用与其氧化的磷胆碱特异性结合位点密切相关。
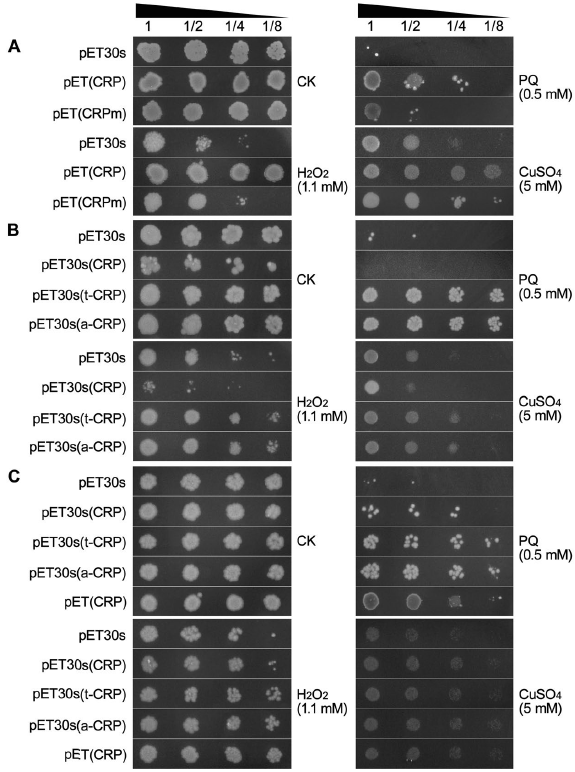
图1.用连续稀释(1倍、2倍、4倍、8倍)的点镀试验,比较正常条件(CK)和1.1 mM H2O2不同氧化应激条件下,大肠杆菌重组菌株pET(CRP)、pET(CRPm)、pET30s(CRP)、pET30s(t-CRP)、pET30s(a-CRP)和pET30s对照菌株的菌落生长情况。0.5 mm PQ和5 mm CuSO4。(a,b)预先诱导的大肠杆菌细胞。(c)未经预诱导的大肠杆菌细胞。
CRP的抗氧化活性在很大程度上取决于其溶解度。我们进一步分析了CRP在PET(CRP)重组大肠杆菌中的表达,并令人惊讶地未能在SDS-PAGE凝胶上检测到CRP的蛋白带(图2A)。这种低水平的CRP表达可能是由于在pET(CRP)中引入了一个新的核糖体结合位点(RBS),以取代原来的pET序列载体中翻译效率高的t7 g10先导序列。因此,我们将CRP基因插入pET30s骨干的nco i位点后,重建了表达载体pET30s(CRP),在这种情况下,CRP的表达显著增强到一个极端水平,但重组CRP(即-CRP)几乎不溶于水,聚集成包涵体。在身体上(图2B)。因此,我们利用两种已知的顺式增溶剂,即高酸性融合小肽Tua2(41 aa)和ATS(43 aa),利用融合策略来提高CRP的可溶性表达。我们在CRP的n末端添加tua2或ats部分,分别创建融合表达载体pET30s(t-CRP)和pET30s(a-CRP)。表达的融合蛋白tua2-CRP(即t-CRP)和ats-CRP(即a-CRP)通常是高水平的(图2C、D),溶解性显著增加(分别为37.5%和38.9%),表明这两种超酸性融合小肽对CRP溶解度具有本质上的增强作用。

图2.用SDS-PAGE分析了不同CRP重组载体(包括pET(CRP)(a)、pET30s(CRP)(b)、pET30s(t-CRP)(c)和pET30s(a-CRP)(d)在大肠杆菌中的蛋白表达。M:蛋白质分子量标记物;Ui:未诱导细菌细胞的粗裂解液;T:诱导细菌细胞的粗裂解液;P、S:离心后诱导细菌细胞裂解液(T)的颗粒和上清液部分。
然后,我们再次采用点镀法研究了新构建的CRP重组大肠杆菌预诱导菌株的抗氧化能力。在正常条件下(CK),含有CRP融合表达载体(pET30s(t-CRP)、pET30s(a-CRP))的重组菌株对pET30s的对照菌株具有正常的菌落状态,而pET30s(CRP)-重组菌株的细胞生长却被意外抑制。相比之下,所有这些菌株在不同氧化应激(1.1 mM H2O2、0.5 mM PQ和5 mM CuSO4)下对生长均有不同的抑制作用。其中,表达tua2/ats-CRP(即t/a-CRP)融合的重组菌株受试较少,菌落状态更好,而与对照菌株相比,pET30s(CRP)-重组菌株表现出更严重的抑制(图1B)。
基于以上结果,我们认为CRP的抗氧化活性在很大程度上取决于其溶解度。CRP在低表达水平的情况下是可溶的(例如在PET(CRP)-重组菌株中),因此表现出其固有的抗氧化作用。CRP的过度表达(例如在pET30s(CRP)-重组菌株中)导致聚集物进入包涵体。这种折叠异常的CRP可能是不活跃的,反而对大肠杆菌的生长有毒。当与增溶剂融合时,大量的CRP蛋白融合(tua2/ats-CRP)(例如在pET30s(t/a-CRP)-重组菌株中)仍然具有相当大的溶解性,并保留抗氧化活性以保护大肠杆菌细胞免受氧化损伤。
为了证实这一假设,我们对所有形式的CRP重组菌株进行了额外的点镀试验,使用未经预诱导的大肠杆菌细胞。可以想象,仅在固体平板上诱导的重组蛋白的表达非常缓慢,因此水平相对较低,但溶解性较高。在这些情况下,通过比较菌落生长状况判断,较低的CRP在较长时间内抑制了pET30s(CRP)-重组大肠杆菌菌株的生长,而在不同的氧化应激下恢复了其抗氧化作用。当然,表达更多可溶性tua2/ats-CRP融合物的重组菌株甚至表现出相对更强的抗氧化能力,而天然低CRP表达的pET(CRP)-重组菌株仍然保持着强大的抗氧化活性(图1C)。显然,这些结果与我们假设的CRP的抗氧化能力与其蛋白溶解性高度相称是一致的。
异源CRP增加了酿酒酵母的抗氧化能力。我们进一步评价了CRP在酿酒酵母等单核细胞中的抗氧化作用,采用连续稀释的酵母点状电镀试验。一般来说,与大肠杆菌系统相比,重组蛋白在酿酒酵母中的表达效率很低。因此,即使在酵母细胞预诱导一段时间后,表达的CRP仍可能低于触发严重聚集的阈值水平,并保持一定程度的溶解性。同时,表达的tua2/ats-CRP融合在理论上更容易溶解。我们发现,在不同氧化应激(30 mM H2O2、0.2 mM PQ和4 mM CuSO4)下,所有被测酵母菌株均表现出不同的生长抑制作用,尽管在无应力状态(CK)下菌落状态相似。正如预期的那样,pyes2(CRP)重组酵母菌株的菌落生长明显优于pyes2质粒的对照菌株,但这两个重组菌株携带CRP融合酵母表达载体pyes2(t-CRP)和pyes2(a-CRP)的菌落生长均优于对照菌株(图3)。这些结果表明,外源性CRP增强了酿酒酵母的抗氧化能力。此外,通过与高酸性伙伴Tua2(ATS)融合以获得更高的溶解性,这一效应可以得到强化,再次反映出CRP介导的抗氧化活性与其溶解性之间的正相关。总的来说,酵母的这些结果与上述细菌的发现是一致的。

图3.用连续稀释液(1倍、10倍、100倍、1000倍、10000倍)点滴法比较Pyes2(CRP)、Pyes2(t-CRP)、Pyes2(a-CRP)和正常条件下Pyes2对照品系(ck)和不同氧化应激下酵母细胞的菌落生长和预诱导。30 mm H2O2、0.2 mm PQ和4 mm CuSO4的SSE。
讨论
在人类和动物中,炎症通常是由病理性氧化应激下过量的活性氧引起的,并且在很大程度上可以认为它与氧化平行。CRP与炎症密切相关,因此肯定与氧化有关。迄今为止,CRP的促炎和抗炎作用已被报道,但仍在争论中,CRP与炎症的确切关系尚不清楚。这种混淆可能是由于当前的研究几乎集中关注CRP在先天免疫中的信号作用,而忽视了其对氧化的直接反应。注意到CRP作为一个PRR成员可以结合先天免疫中的氧化特异性表位OxPC,从其识别特性中推断出一种假定的抗氧化作用,但仅在vitro39,40中很少进行评估。在本研究中,我们在非动物有机体中异源表达CRP,从而排除了其信号作用,并首次提出了这一推论的体内具体证据。