摘要
基本原理:
婴儿心脏手术后碱性磷酸酶活性降低与术后心血管支持需求增加相关。在接受冠状动脉旁路移植的成人中,碱性磷酸酶输注可以减少炎症。这些作用的机制尚未探讨,但可能包括细胞外腺嘌呤核苷酸转化为腺苷的减少。
实验目的:
1)评估碱性磷酸酶活性与婴儿心脏手术后腺苷一磷酸腺苷的转化率之间的关系;
2)评估血清碱性磷酸酶的抑制/补充是否调节了这种转化。
研究方法:
从75名婴儿(4个月)获得旁路前/后血清样本。用/不选择性抑制碱性磷酸酶和CD73来评价13C5单磷酸腺苷向13C5腺苷的转化。使用低浓度和高浓度13C5单磷酸腺苷(模拟正常/应力浓度)。还评估了碱性磷酸酶补充对一磷酸腺苷清除率的影响。血清碱性磷酸酶活性的变化与13C5腺苷的产生有无CD73抑制作用密切相关(r = 0.83;P < 0.0001)。低碱性磷酸酶活性(80 μ/L)的血清产生的13C5腺苷明显减少,特别是在高浓度13C5腺苷一磷酸(10.4 μmol/L vs 12.9 μmol/L);P = 0.0004。碱性磷酸酶的抑制导致13C5腺苷的产量显著下降(11.9 μmol/L对2.7 μmol/L;P < 0.0001)。补充生理剂量的人组织非特异性碱性磷酸酶或高剂量的牛肠碱性磷酸酶使13C5单磷酸腺苷转化为13C5腺苷(p < 0.0001)。
结论:
碱性磷酸酶代表婴幼儿心脏手术后的原发性外切核酸酶,低术后碱性磷酸酶活性导致清除腺苷一磷酸的能力受损。AP补充提高血清清除腺苷一磷酸腺苷。这些发现是心脏手术中碱性磷酸酶输注的潜在治疗机制。
新品推荐
我们确定碱性磷酸酶(AP)是体外循环婴儿的主要可溶性外核苷酸酶,当AP活性降低时,其清除AMP的能力降低。活体外补充AP可提高这一能力,并可能代表第2阶段研究中发现的AP输注的有益治疗机制。
引言
先天性心血管缺陷是儿童发病率和死亡率的一个重要原因。仅在美国,据估计55岁之前就有189000年的寿命因先天性心血管缺陷而丧失,与白血病和哮喘相比较。生还者经常受到严重的病态影响,包括慢性心力衰竭、肾衰竭、肝功能不全、肠道损伤和神经损伤。
在先天性心脏病患儿中,心胸外科加体外循环(CPB)常常是必要的救命手术。不幸的是,手术和CPB本身通常会导致多种全身性紊乱,包括全身缺血/再灌注、全身炎症反应综合征和器官功能障碍,包括低心输出综合征。患有复杂先天性心脏损伤的婴儿在围手术期具有特别高的受伤风险,需要新的治疗方法来降低这类人群的急性和慢性发病率。
最近的证据表明,碱性磷酸酶(AP)作为宿主防御系统的一部分,对多种疾病过程中的炎症和组织损伤具有潜在作用。
碱性磷酸酶是一种在血清和大多数器官中存在的内源性金属酶家族。用CPB进行心脏手术的婴儿表现出术后血清AP活性急剧下降,术后第1天的低活性与炎症增加和心血管支持需求增加有关。成人心脏手术患者的AP活性也出现了类似的下降,并进行了持续性的初步研究。冠状动脉旁路移植术中的AP输注导致全身炎症显著减少。
在这种情况下,AP的潜在治疗机制尚不清楚。所有AP都能针对多种分子进行水解磷酸酶活性。近年来,与人类健康和疾病相关的AP的具体目标已经被描述。也许最有趣的靶点是在缺血/再灌注损伤期间通过细胞凋亡或坏死释放的细胞外腺嘌呤核苷酸。细胞外三磷酸腺苷(ATP)、二磷酸腺苷(ADP)和一磷酸腺苷(AMP)导致炎症激活、血管收缩和血小板活化,而这些底物逐步去磷酸化为腺苷可能具有保护作用。外-5’-核苷酸酶(CD73)被认为是能够将细胞外AMP去磷酸化为腺苷的主要酶。然而,在健康新生儿中,可溶性AP具有将AMP转化为腺苷的类似能力。
考虑到AP在健康新生儿中的作用,我们假设在婴幼儿心胸手术后常规观察到的AP活性降低会导致血清去磷酸化胞外AMP的能力降低。我们还试图证明AP在该病理结构中仍然是主要的血清外切核苷酸酶,并且血清将AMP转化为腺苷的能力将与残留AP活性相关。总之,这些结果将有助于确定婴儿心胸外科手术后低AP活性与炎症和增加心血管支持需求之间的关键机制。此外,尽管AP治疗在多种疾病的早期结果很有希望,但治疗性AP治疗对腺嘌呤核苷酸清除和腺苷产生的影响尚不清楚。因此,我们探讨了外源性AP补充剂对AMP去磷酸化的体外作用,以评估AP是否作为其治疗机制的一部分调节这一途径。
实验结果
AP抑制
血清AP活性与血清13C5腺苷生成之间的强相关性是高度提示AP是我们的患者人群中的主要血清外切核苷酸酶。为了直接检测AP对腺苷产生的作用,我们使用已知的TNAP选择性抑制剂(MLS-0038949)来阻断来自高浓度13C5-AMP受试者26-50的术后样本中的AP活性(图1)。TNAP的抑制导致13C5腺苷的产量显著下降(11.9μmol/L对2.7μmol/L;p<0.0001)。相比之下,选择性抑制CD73对抑制13C5腺苷生成的作用明显低于TNAP(8.3μmol/L对2.7μmol/L;p<0.0001)。
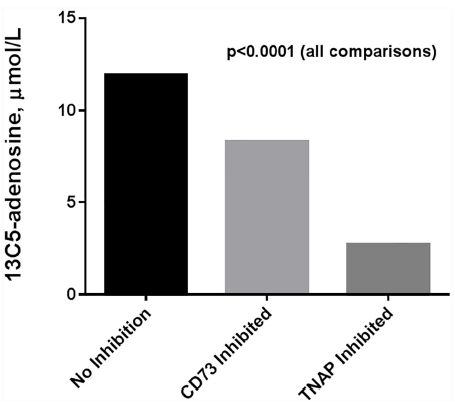
图1.无外核苷酸酶抑制、CD73抑制和碱性磷酸酶抑制的13C5腺苷生产。TNAP = 组织非特异性碱性磷酸酶。
AP增补
平均而言,仅在低浓度下添加13C5-AMP的40%和高浓度添加的13C5-AMP的25%,从最初的50个受试者中转化为13C5腺苷,在反应终止时在血清中留下13C5-AMP的显著浓度。AP治疗疾病的一个有益机制是增加AMP和其他细胞外腺嘌呤核苷酸对腺苷的清除率。因此,作为最后的测定,我们探讨了添加外源性AP对血清清除13C5-AMP腺苷的影响,从最终25名受试者收集的样本中。最初的测试是使用BIAP进行的,因为这是目前在败血症、溃疡性结肠炎和心脏手术治疗试验中评估的配方。随后,我们添加人肝AP,一种在人血清中通常存在的亚型,以评估加性效应。
这些分析结果如图2所示。在所有组中,AP的补充导致13C5腺苷的产生在统计学上显著增加(p<0.0001)。对不同的AP方案进行比较,在0.05水平上检验其显著性,并进行多次比较。加入低剂量BIAP(500U/L)后,13C5腺苷与基线相比有1.9μm的适度增加,但没有达到统计学意义。将BIAP增加到高剂量(50000 U/L),导致13C5腺苷的产量在统计学上显著增加(平均增加24.4μmol/L)。在这一水平的BIAP活性下,约90%的13C5-AMP转化为13C5腺苷。
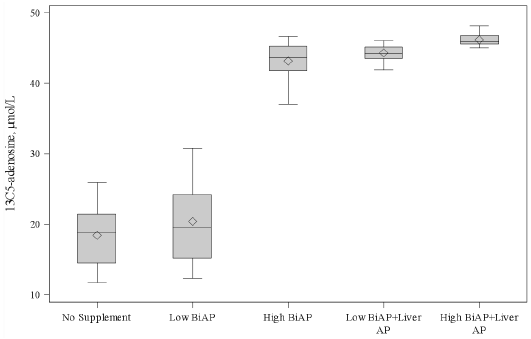
图4.13C5腺苷生产与体外碱性磷酸酶增补。
讨论
尽管从细菌到人类都保存着这些酶,但对AP的生理作用知之甚少。人类组织中AP非特异性形式的错义突变导致PPI水解失败和严重的低磷血症临床综合征。血清和基于组织的AP的其他功能还不太清楚。
研究局限性
我们的研究确实有一些局限性。最显著的是,很难直接评估AP对天然细胞外腺嘌呤核苷酸和天然腺苷产生的影响。一旦生产的稳定状态被打破,腺苷通过ADA1迅速清除,或通过ENT1,2进入细胞,难以精确测量。由于我们的目标主要是了解AP在AMP转化为腺苷的作用,我们决定适应由佩滕吉尔等人建立的体外模型,使用外源AMP作为供应,并通过去除细胞含量和阻断ADA1和EtT1,在血清中捕获腺苷。去除细胞成分去除了外切核苷酸酶的来源,但使我们能够专注于从临床试验角度最相关的血清成分。我们还决定只关注AMP作为基板,以简化模型。
然而,在这种情况下,AP可能能够脱去磷酸化ATP和ADP,这应该在未来的研究中进行测试。我们的模型不考虑AP的组织水平作用,因此有必要进一步研究基于组织的AP在体外循环中对器官损伤和炎症的作用。本研究旨在评估血清AP活性与血清清除透明质酸的关系。这项研究没有对该人群中AP活性下降的病因有重要的了解,也没有评估围手术期药物与AMP的AP去磷酸化之间的潜在效果改变。我们中心正在进行更多的研究,以进一步评估婴儿心血管手术后AP活动丧失的时间和原因。
最后,我们的研究并没有解决什么是临床上重要或安全的变化,血清AMP清除能力,而最常见的生理学心脏手术后,是一个高系统血管阻力和低心输出量后负荷减少是PRIM。在治疗策略上,过多的腺苷也可能是导致过度血管扩张和低血压的问题。过多的腺苷也可能导致血小板活性下降,并可能增加术后出血。在这种情况下对AP的未来体内研究应涉及最佳剂量和腺苷的产生。
结论
AP代表婴幼儿心脏手术后的原发性外切核酸酶,术后AP活性低导致该模型中AMP清除能力受损。随着AMP浓度的升高,AP的作用显得尤为突出。AP补充提高血清清除腺苷腺苷,但AP同工酶可能具有不同的效力。总之,这些发现指出了心脏手术和其他炎症/组织损伤状态下AP治疗的潜在生物学机制。








