2024年1月8日,来自复旦大学王菲菲研究团队在《中国药理学报》上发表了标题为“O-GlcNAcylation mediates H2O2-induced apoptosis through regulation of STAT3 and FOXO1.”的研究成果,探明O-GlcNAc糖基化修饰通过调控STAT3和叉头盒蛋白O1 (FOXO1)介导H2O2诱导的细胞凋亡。
据介绍,O-GlcNAc糖基化是一种关键的翻译后修饰,将外部刺激与细胞内信号转导网络偶联。然而,O-GlcNAc糖基化在氧化应激诱导的细胞凋亡中的关键蛋白靶点仍有待阐明。
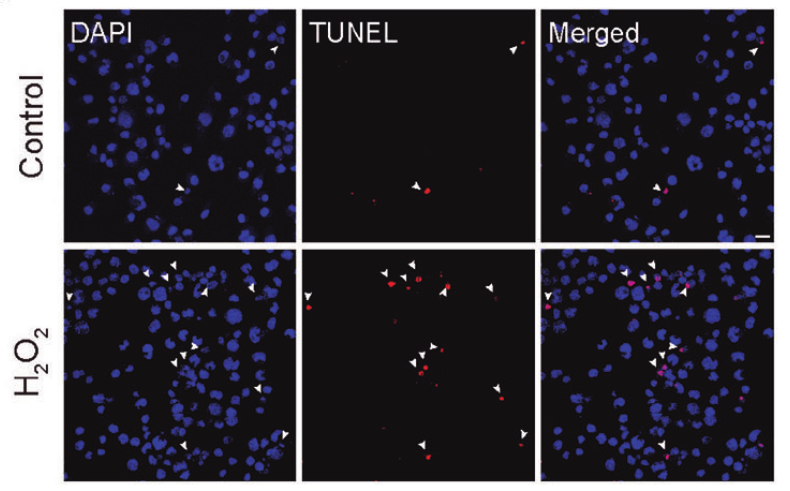
研究人员发现H2O2处理抑制O-GlcNAc糖基化,损害细胞活力,增加裂解caspase 3,加速神经母细胞瘤N2a细胞的凋亡。O-GlcNAc转移酶(OGT)抑制剂OSMI-1或O-GlcNAcase (OGA)抑制剂Thiamet-G分别增强或抑制H2O2诱导的细胞凋亡。OSMI-1抑制了总蛋白和磷酸化蛋白水平以及转录因子3 (STAT3)和FOXO1的启动子活性。
相反,过表达OGT或用Thiamet-G处理会增加STAT3和FOXO1的总蛋白水平。STAT3或FOXO1过表达可消除 OSMI-1诱导的细胞凋亡。而在H2O2处理的细胞中,OGT和Thiamet-G的抗凋亡作用通过下调内源性STAT3或FOXO1的表达或活性而被消除。这些结果表明STAT3或FOXO1是参与H2O2诱导的N2a细胞凋亡的O-GlcNAc糖基化的潜在靶点。
文章来源:
Zhang, Chen-chun, Li, Yuan, Jiang et al, O-GlcNAcylation mediates H2O2-induced apoptosis through regulation of STAT3 and FOXO1.DOI: 10.1038/s41401-023-01218-z.《中国药理学报》,最新IF:8.2