近日Michel Sadelain的研究团队在《Nature》上发表研究结果,发现面对来势汹汹的CAR-T治疗,癌细胞竟然能把自身的抗原转移到CAR-T细胞上,在逃避免疫治疗的同时让CAR-T细胞自相残杀。
CAR-T治疗,通过在患者自身的T细胞上引入肿瘤特异性嵌合抗原受体,让T细胞能更好地识别杀伤肿瘤,在很多血液系统肿瘤中取得了很好的效果。
不过CAR-T效果虽好,肿瘤复发的问题却也屡见不鲜。而这些复发的癌细胞上,原本被CAR-T靶向的抗原,要么完全消失,要么大幅减少,让肿瘤对CAR-T治疗产生了耐药性。
其中,完全丢失主要是由肿瘤的各种基因突变造成的,但那些抗原靶点大幅下调,却没有完全消失的癌细胞,是怎么让抗原靶点下调的却一直不清楚。对此,研究人员对急性淋巴细胞白血病(ALL)模型小鼠,给予了有限的,分别携带CD28(19-28ζ)或者4-1BB(19-BBζ)共刺激因子的CAR-T治疗,模拟了CAR-T治疗后的复发。
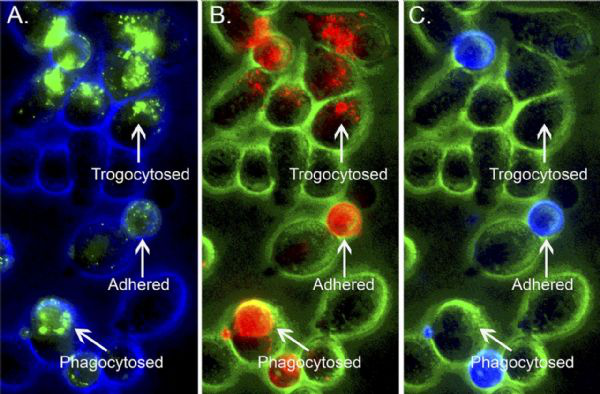
(胞啃、粘附和吞噬)
进一步研究发现,只有那些具有胞啃(trogocytosis)能力的19-BBζ细胞,才会接受癌细胞上的靶抗原。除了减少癌细胞上的抗原数量,让癌细胞耐药外,胞啃还让CAR-T细胞带上了它所要攻击的靶点,使它们互相残杀。
(评论:那岂不是通过不同CAR-T细胞联合治疗能够用于抵抗细胞胞啃作用导致的负面作用)
原始出处:
Hamieh M, Dobrin A, Cabriolu A, et al. CAR T cell trogocytosis and cooperative killing regulate tumour antigen escape. Nature. 2019 Mar 27.
2、Nature:化学感应调节神经回路的钠食欲
Lee S等研究人员在Nature发表题目为:”化学感应调节神经回路的钠食欲
”的文章,这项研究揭示了一种神经结构,它整合了化学感应信号和维持钠平衡的内在需求。

钠是细胞外液中的主要阳离子,它调节各种生理功能。体内钠的消耗增加了钠味的享乐价值,这促使动物摄入钠。相比之下,检测到口服钠可迅速淬灭对于钠的食欲,这表明味觉信号在钠的食欲和饱食中具有重要作用。然而,至今为止,我们对于基于化学感受的食欲调节的神经机制仍然知之甚少。
研究人员通过整合化学感应和内部耗尽信号来识别小鼠中通过基因定义的神经回路,来控制钠摄入。发现,蓝斑前体中的一部分兴奋性神经元表达前内啡肽,并且这些神经元是钠摄取行为的关键神经基质。对该群体的急性刺激引发了即使从岩盐中摄取钠的强烈摄入,同时引起厌恶信号。抑制相同的神经元选择性地减少钠消耗。
研究人员进一步证明,钠的口服检测可以迅速抑制这些钠 - 食欲神经元。同时体内光学记录和胃输注显示,钠味 - 但不是钠摄入本身 - 是表达前体蛋白的前蓝斑中的神经元的急性调节和钠食欲的饱食所需的。
此外,逆行病毒追踪显示,感觉调节部分是由纹状体末端床核中特定的GABA(γ-氨基丁酸)产生神经元介导的。这种抑制性神经群体通过钠摄入激活,并向钠 - 食欲神经元发送快速抑制信号。
(评论:神经元能促进动物摄取盐分的欲望,这让我们对大脑又有了进一步的人认识。)
原始出处:
Lee S et al. Chemosensory modulation of neural circuits for sodium appetite. NATURE, 2019; doi: 10.1038/s41586-019-1053-2.
3、Nature:肠-脑信号传递饮料渗透压,控制饮水
Zachary Knight 教授团队近日在Nature发表题目为:“肠-脑信号传递饮料渗透压,控制饮水”的研究结果,揭示了流体稳态系统如何监测摄入流体的渗透压,以动态控制饮水行为。
饱食是饮食过程中减少食欲的过程。对于口渴,口咽线索通过向大脑报告已经摄取的液体量来驱动饱食,从而起到关键作用。相比之下,传递摄入液体的渗透压的机制仍然知之甚少。
最近,研究人员发现,胃肠道的水和盐含量能够被精确测量,然后迅速传递到大脑,以控制小鼠的饮水行为。
研究人员证明,这种渗透信号对于正常饮水期间的饱食是必要和充分的,涉及迷走神经,并且传递到控制口渴和加压素分泌的关键前脑神经元。
使用显微内窥镜成像,研究人员发现,单个神经元通过将这种胃肠道感觉信息与口咽和血液传播信号相结合来计算体内平衡需求。
(评论:肠道竟能如此精准地测量盐的浓度!)
原始出处:
Zimmerman CA et al. A gut-to-brain signal of fluid osmolarity controls thirst satiation. NATURE, 2019; doi: 10.1038/s41586-019-1066-x.