| Abbkine产品:EliKineTM Free Triiodothyronine (fT3) ELISA Kit(KET0004) 英 文 名:CD8+ T cells induce cachexia during chronic viral Infection 杂 志:nature immunology 2019 影响因子:23.53 |
研究背景:
慢性疾病如感染和恶性肿瘤患者常面临恶病质,这是一种多因素综合征,可加重潜在疾病并恶化预后。恶病质表现为行为症状和代谢症状,其严重程度因疾病和个体而异,难以定义和诊断。恶病质患者表现为厌食症、快感缺乏症和嗜睡,以及体重意外下降5%以上。这是由脂肪和瘦肉块的迅速消耗引起的,这不仅影响患者的生活质量,而且往往是发病率和死亡率的主要原因。传统的营养支持不能逆转恶病质。虽然已经探索了几种治疗方案,如生食欲激素促生成素激动剂,但预防或减轻恶病质的护理标准仍不明确。
恶病质的出现伴随着大量的促炎细胞因子如肿瘤坏死因子(TNF)、干扰素(IFN) -γ,白介素(IL) 6和IL-17 。根据疾病模型,这些细胞因子可由肿瘤细胞分泌,如癌症、宿主免疫细胞和/或参与代谢调节的细胞,如脂肪细胞。癌症相关恶病质(CAC)小鼠模型极大地提高了我们对体重减轻机制的理解。然而,适当的机制模型研究恶病质的背景下感染仍不发达。在本研究中,我们使用了慢性病毒感染的小鼠基准模型来探讨感染相关恶病质(IAC)的分子和细胞需求。我们设计了一种遗传、饮食和药理学干扰的综合方法来揭示CAC和IAC的共同和独特特性。这导致了脂肪组织形态学、分子和代谢变化的表征,并确定了IAC的主要免疫驱动因素,为恶病质的病理生理学提供了急需的分子研究。
研究目的:
恶病质是各种癌症、慢性炎症和感染的主要发病和死亡原因。对恶病质发生机制的了解仍然有限,尤其是对感染相关性恶病质(IAC)。本文描述了一种慢性病毒感染小鼠可逆性恶病质模型,并确定了CD8+ T细胞在IAC中的重要作用。与癌症相关恶病质相关的细胞因子与IAC无关。相反,病毒特异性CD8+ T细胞引起脂肪组织的形态学和分子变化,导致脂质储存的枯竭。这些变化发生在CD8+ T细胞反应峰值之前的时间点,需要T细胞固有的I型干扰素信号和抗原特异性启动。我们的研究结果将全身抗病毒免疫反应与脂肪组织重塑联系起来,揭示了CD8+ T细胞在IAC中的作用被低估。
材料方法
1.实验材料:C57BL/6野生型和基因突变型小鼠模型,(2 ×106 FFU) LCMV strain clone 1病毒
2.实验方法:小鼠热量测定,灌喂实验,抗体和药物治疗,EchoMRI-100H (EchoMRI LCC)成像技术,病理实验(HE染色,IF),血清检测,ELISA实验(KET0004, Abbkine),RT-PCR,流式细胞术,RNA-seq等。
实验结果:
感染LCMV克隆13可导致可逆性恶病质。野生型C57BL/6J小鼠感染淋巴细胞性脉络丛脑膜炎病毒(LCMV)慢性株克隆2 106个焦点形成单元(FFU),感染后第一周体重下降15 20%(图1a)。为了评估这是恶病质的表现还是厌食症的直接结果,我们给感染了LCMV的小鼠喂食未感染的野生型小鼠,在感染后的两周内喂食与感染LCMV的小鼠相同数量的食物(成对喂食)。感染后6 - 8天,未感染组体重下降不到初始体重的3%,而感染组体重下降超过10%(图1a,b),说明厌食喂养行为不能完全解释LCMV感染小鼠体重下降的全部程度。
为了描述感染诱导的病理生理学,我们使用代谢笼来监测LCMV感染小鼠与年龄和性别匹配的未感染小鼠的比较。感染后第6天和第8天之间,与未感染的小鼠相比,小鼠表现出嗜睡的迹象,并显示出食物和水的摄入量、活动和能量消耗减少(图1b d和补充图1a)。
由CO2排放与O2消耗比值计算的呼吸交换率(respiratory exchange ratio, RER)在感染后第6天至第8天之间显著降低(图1d和补充图1a),说明LCMV感染小鼠主要依赖脂肪代谢作为能量底物。这些病理生理变化先于病毒负荷和适应性免疫反应的峰值,后者发生在第8-12天(见补充图1b-d)。第8天之后,尽管病毒持续存在,小鼠的体重开始缓慢回升(图1a-c和补充图1a-d)。
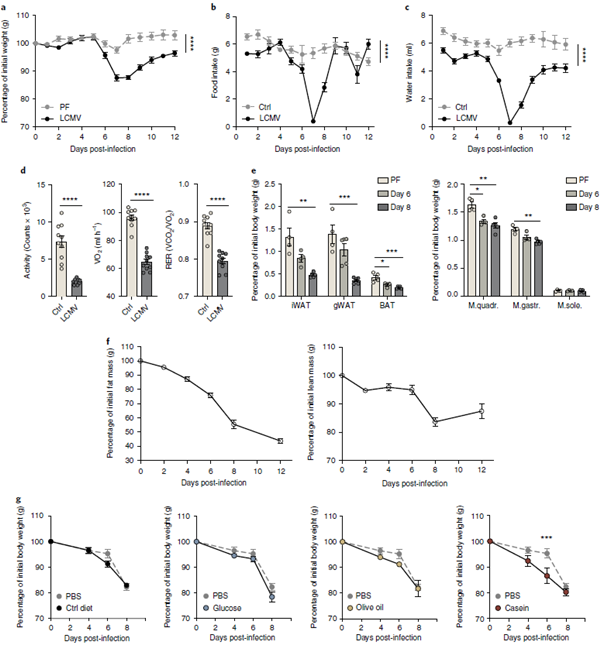
图1 感染LCMV克隆13导致瞬时恶病质。
通过比较身体组分,我们发现,与成对喂养、未感染的小鼠相比,感染后的第一周,脂肪和瘦肉块(肌肉)均严重减少(图1e,f)。然而,与肌肉相比,脂肪组织在感染后4天内经历了更早、更严重的消耗(图1f)。随着时间的推移,这种消耗影响了不同的脂肪库,包括腹股沟白色脂肪组织、性腺白色脂肪组织和肩胛间棕色脂肪组织(图1e)。为了评估肌肉质量的损失,我们检查了股四头肌、腓肠肌和比目鱼肌,它们同时代表慢肌和快肌。感染小鼠的四头肌和腓肠肌的肌肉质量与成对喂养的小鼠相比有所下降(图1e)。这与成肌细胞分化标记物MyoD1的表达降低、编码Atrogin1和Murf1的Fbxo32和Trim63的表达增加有关,与成对喂养的小鼠相比,受感染小鼠的这三种肌肉均参与蛋白酶体降解(见补充图1e g)。
为了评价病毒接种量与体重减轻之间的关系,我们测定了LCMV克隆13的感染剂量,范围从2 106 FFU到2 102 FFU。低病毒接种组体重减轻明显改善;低于2104 FFU的剂量显示体重几乎没有下降(见补充图1h)。这些较低的病毒接种被认为与加速病毒清除有关。急性LCMV感染与低剂量LCMV克隆13感染的体重动力学相似(见补充图1i),提示病毒持久性的决定因素可能与恶病质的发生有关。
为了检验营养补充是否能改善体重减轻,我们在感染后第4天至第8天之间,使用口服灌胃给LCMV克隆13只受感染的小鼠每日1千卡的类似于高汤的控制饮食、葡萄糖、橄榄油或酪蛋白。与补充pbs的对照组相比,口服灌胃并没有减轻体重(图1i)。相反,与补充pbs的lcmv感染小鼠相比,所有补充灌胃组的恢复速度都较慢(见补充图1j),这表明病毒引起的体重下降无法通过营养补充来预防。这些结果揭示了13只LCMV克隆感染小鼠恶病质的几个特征,包括厌食症和代谢功能障碍,以及无法通过营养补充逆转的脂肪和肌肉量减少。
病毒感染引起脂肪组织重塑和脂肪分解。与未感染的对照组相比,LCMV感染小鼠脂肪组织的皮下和内脏室均发生衰竭(图2a)。通过组织学分析,与未感染小鼠相比,感染LCMV的腹股沟脂肪组织的形态学变化,我们观察到感染后第6天和第8天脂肪细胞的大小显著减小(图2b,c)。接下来,我们测定了LCMV感染后第0、4、6和8天腹股沟脂肪组织中脂肪甘油三酯脂肪酶(ATGL)和激素敏感脂肪酶(HSL)的蛋白质丰度和激活状态,这两种酶是脂肪溶解的两个中心酶。与未感染的小鼠相比,LCMV感染期间腹股沟脂肪组织中ATGL和HSL以及磷酸化HSL(PHSL)的表达在Ser660残基处磷酸化,这表明感染后第6天脂肪分解峰值增加。这与未感染的对照组相比,LCMV感染小鼠血清中非酯化脂肪酸(NEFAs)水平升高(图2E)证实了这一点。
此外,脂蛋白脂酶(LPL)的减少信使RNA的表达,并在较小程度上降低了腹股沟脂肪中的脂肪清除受体CD36,以及与被喂食的未感染小鼠相比,LCMV感染小鼠血清中甘油三酯水平的升高(图2E,F),IN。降低脂肪组织中的脂质摄取率和/或肝脏中的脂质动员。Dgat2(甘油三酯生物合成中的限速酶)的mRNA表达下降(图2f),也表明LCMV感染的MICE15脂质合成率较低。值得注意的是,感染小鼠的腹股沟脂肪垫显示血管化增加(参见补充图2b,c),这可能与炎症介导的组织重塑有关。总之,这些数据表明,LCMV克隆13感染通过调节脂质代谢的关键调节因子导致脂肪组织中脂质储存的耗尽。
为了研究病毒诱导的脂肪组织衰竭是否遵循与CAC相似的机制,我们检测了UCP1的mRNA表达作为脂肪组织老化的指标。感染小鼠的帽间、腹股沟和性腺脂肪中ucp1的mRNA表达比成对喂养小鼠略低(图2g)。根据Lewis肺癌恶病质模型和ATGL/和HSL/MICE16黑色素瘤模型,ATGL或HSL的缺失足以改善恶病质小鼠的体重减轻,ATGL/的缺失更为深刻,说明ATGL和HSL在CAC中的重要作用。为了确定IAC是否需要这些脂肪酶,我们感染了atgl fl fl adipoqcre/+和hslfl/fl adipoqcre/+小鼠,这些小鼠在脂联素(adipoqq)启动子的驱动下有条件地切除脂肪细胞中的atgl和hsl。我们发现,与氟化物对照组相比,两种脂肪酶的消融术均不能降低LCMV感染期间的体重减轻程度(图2h),这表明IAC不需要脂肪酶。
激素生长激素释放肽和脂肪因子(如瘦素和脂联素)被认为是代谢和免疫过程的活性调节剂。LCMV感染和未感染小鼠血清生长激素释放肽的数量和腹股沟脂肪组织脂联素的表达相似(见补充图2D,F)。值得注意的是,循环中的瘦素水平显示LCMV感染减少,而第6天腹股沟脂肪组织中瘦素的mRNA表达增加(参见补充图2e,f),这表明瘦素可能参与了IAC期间脂肪组织的消瘦。然而,瘦素缺乏的lepob/ob小鼠在LCMV感染后体重下降率与lepob/+小鼠相似,并表现出厌食(参见补充图2g)。我们还量化了lepob/ob和lepob/+小鼠感染后8天内的脂肪和瘦肉量的损失,发现两组的脂肪和瘦肉室的消耗量相等(参见补充图2h),这表明,尽管瘦肉素在脂肪组织中的表达量增加了,但它却降低了小鼠的脂肪和瘦肉量。不介导LCMV感染过程中的活性脂肪溶解状态或进食行为的中断。这些结果表明,IAC在感染后第6天到第8天之间触发脂肪组织的结构和代谢重编程。
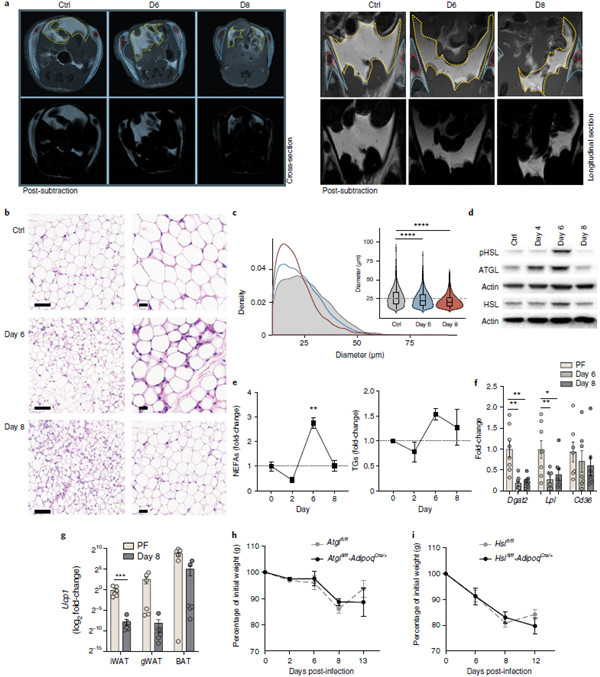
图2 |感染相关性恶病质引发严重的脂肪组织重塑和脂肪分解增加。
感染相关的恶病质由I型干扰素和CD8+T细胞驱动。在各种恶病质和脂肪组织重塑模型中,细胞因子如IFN-γ、TNF和IL-6触发体重减轻,独立或与其他细胞因子和免疫细胞一起发挥作用。对32种细胞因子进行珠子的多重分析,以及IFN-α和IFN-β的ELISA检测,发现血清细胞因子具有高度动态的模式,并且在野生型LCMV克隆13感染后的第一个96小时内,IFN-γ、TNF、IL-6、IFN-α和IFN-β的诱导。小鼠(图3a和补充图2a和补充表1)。参与CAC的细胞因子,如IL-1β和白血病抑制因子8,19,LCMV感染小鼠的血清没有增加(参见补充图3A和补充表1)。与促炎细胞因子相关的途径,如IFN-γ、TNF和IL-6与Cac8,20有关。通过使用ifng/、tnf/和tnfri/小鼠进行基因消融术中和ifn-γ、tnf和il-6,或在感染前1天开始抗体介导的阻断,然后每2天继续进行,不能改善LCMV感染小鼠的体重减轻(图3b,c)。
感染的小鼠,我们同时使用中和抗体去除干扰素-γ和肿瘤坏死因子,在感染后第8天仍然损失高达20%的体重(图3b)。在感染的前2天内,LCMV感染小鼠血清中检测到1型IFNs(图3A)21。与野生型LCMV感染小鼠(图3d和补充图3b,c)相比,使用IFNAR1/小鼠对IFN-α/β-受体α链(IFNAR)信号的遗传消融导致感染后8天体重减轻约10%,这表明I型IFN反应与IAC有关。
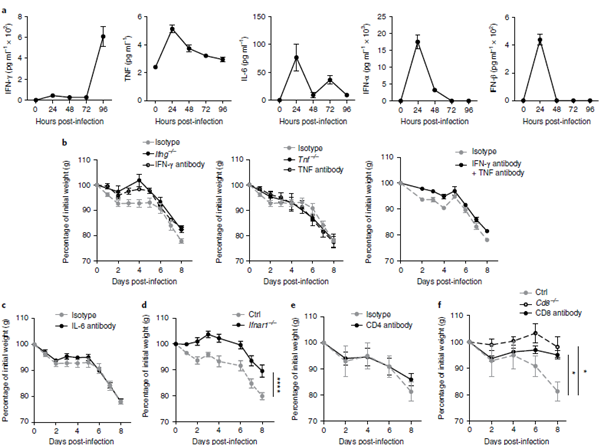
图31型IFN和CD8 T细胞在诱导感染相关性恶病质中起重要作用。
接下来,我们确定一个特定的T细胞群体是否在LCMV感染期间介导体重减轻。这是通过在LCMV感染(图3e、f)或CD8/小鼠感染(图3f)前2天和1天分别静脉注射CD8+T细胞和CD4+T细胞的消耗性抗体来完成的。在LCMV感染的小鼠中,CD4+T细胞的耗竭不能保护体重减轻(图3e和补充图3d f);但是,与野生型对照组相比,CD8+T细胞的耗竭几乎没有导致体重减轻(图3f和补充图3d-f)。这些结果提示CD8+T细胞在IAC中起着关键作用。
创新点
在这项研究中,为了阐明IAC是炎症因子,研究人员运用了一个慢性病毒感染模型。IAC在感染后6天出现,在第12天出现适应性免疫反应高峰之前,随后逐渐消退,与Cac3,5的终末病程相反。在本研究中报道了I型干扰素和CD8+T细胞在触发IAC中的作用,但不包括IL-6、TNF和IFN-γ,后者是经常介导Cac6,8的细胞因子。IAC的表现除了抗原特异性CD8+T细胞受体启动外,还需要T细胞而非脂肪细胞内特异性的IFNAR1信号传导。细胞溶解效应分子穿孔素的缺失或淋巴器官T细胞出口的药物阻断均不能阻止恶病质的发生,这提示了除经典的CD8+T细胞介导的细胞毒性以外的其他机制。
本实验多次运用了ELISA试剂盒进行检测,其中亚科因生物(Abbkine)的ELIKINETM试剂盒作为一个重点检测指标来使用,即:
KET0004检测小鼠血液中的游离甲状腺素,使用方法便捷,效果卓越。
Abbkine专注于免疫学和细胞学领域,致力于创新和研发各类抗体、蛋白质、分析试剂与试剂盒,以期成为生命科学研究发展、药物研发等领域的关键推动者。在这里,我们为您呈献蛋白和免疫研究用户最喜爱的产品,从免疫学基础产品,如蛋白提取定量,到免疫学实验的内参标签抗体、一抗及二抗等;细胞研究用户最喜爱的产品,从用于检测细胞状态的染料及试剂盒,细胞器提取试剂盒,细胞亚结构染色示踪及细胞代谢检测产品,到用于细胞培养的细胞因子及蛋白类检测试剂盒,只为助力您的研究事业!
About Abbkine Scientific Co., Ltd.
Abbkine Scientific Co., Ltd.成立于2012年。我们的使命,通过为全球科学家提供人类和动物健康研究所需的基础研究工具,以期成为研究探索的关键推动者。我们将通过明确的核心战略和促进诚信、开放、合作、创新和为客户服务的企业文化,为全球生命科学研究者提供买得起的高品质产品,实现我们的使命。