1、nature:无需CRISPR系统,线粒体碱基编辑器
2020年7月8号,来自HHMI的Joseph Mougous,哈佛大学的David Liu和麻省总医院的Vamsi Mootha三个实验室在Nature杂志上发表了题为“A bacterial cytidine deaminase toxin enables CRISPR-free mitochondrial base editing”的研究论文,发现一种新的无CRISPR的工具让这种基因编辑能力到达了细胞的第二个较小的基因组——线粒体中,这是线粒体DNA的第一个精确基因编辑器。
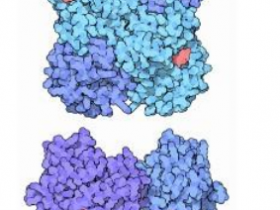
Fig.1 | Non-toxic split-DddAtox halves reconstitute activity when co-localized on DNA in HEK293T cells.
研究人员了一种细菌间毒素,并将其命名为DddA,它可以催化双链DNA的胞苷脱氨。研究人员设计了无毒的split-DddA半分子,并且其在结合靶标DNA之前没有活性。split-DddA半分子、转录激活因子样效应子阵列蛋白以及尿嘧啶糖基化酶抑制剂的融合产生了无RNA的DddA衍生型胞嘧啶碱基编辑器(DdCBE),其可催化人线粒体DNA中的C•G到T•A转化,并具有很高的目标特异性和产物纯度。研究人员使用DdCBE构建了人类细胞中与疾病相关的线粒体DNA突变模型,从而导致呼吸速率和氧化磷酸化的改变。不含CRISPR的DdCBE可以精确操纵线粒体DNA,而非消除线粒体DNA拷贝,这对线粒体疾病的研究和潜在疗法具有广泛意义。
据介绍,细菌毒素是一个巨大的生化多样性储备库,可以重新用于生物医学应用。此类蛋白质包括一类脱氨酶超家族的细菌间毒素,其成员已发现在基因编辑技术中的应用。由于以往报道的胞苷脱氨基酶在单链核酸上运行,因此它们在碱基编辑中需要解开双链DNA,例如通过CRISPR–Cas9系统。迄今为止,线粒体DNA中的碱基编辑受到向导RNA无法进入线粒体的阻碍。因此,对线粒体DNA的操作仅限于通过设计者核酸酶对线粒体基因组的靶向破坏。
(评论:厉害了,无需CRISPR系统,线粒体就可以精准基因编辑 )
文章来源:
Beverly Y. Mok, Marcos H. de Moraes et al. A bacterial cytidine deaminase toxin enables CRISPR-free mitochondrial base editing. DOI: 10.1038/s41586-020-2477-4 Nature. 最新IF:43.07
2、Cell:多功能生物传感器揭示了活细胞中三聚体G蛋白的活性
2020年7月6日,来自美国波士顿大学医学院Mikel Garcia-Marcos研究组在《细胞》杂志上发表题为“Revealing the Activity of Trimeric G-proteins in Live Cells with a Versatile Biosensor Design. ”的研究论文,利用多功能生物传感器揭示了活细胞中三聚体G蛋白的活性。
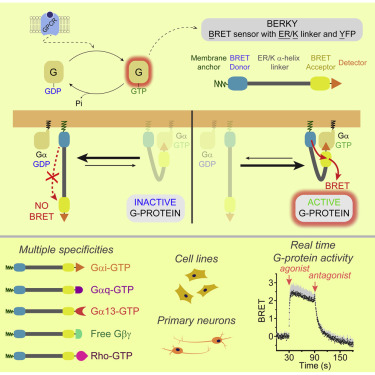
Fig. 2 | CELL截图
研究人员描述了一套光学生物传感器,其可用于检测活细胞中亚秒级分辨率的内源性活性G蛋白。使用模块化设计原理,研究人员为内源性Gα-GTP和游离Gβγ(异源三聚体G蛋白的两种活性物质)开发了基因编码的非分子生物传感器。利用该设计来生成对不同异源三聚体G蛋白或其他G蛋白(例如Rho GTPases)具有特异性的生物传感器。
通过在多种情况下应用生物传感器,包括从表征癌症相关的G蛋白突变体到原代神经元中的神经递质信号传导,研究人员进一步验证了其多功能性。总体而言,这一多功能生物传感器具有高保真度、时间分辨率和便利性,可用于研究活细胞中内源性G蛋白的活性。
据介绍,异三聚体G蛋白(Gαβγ)是GPCR信号的主要转导者,其介导了无数自然刺激和治疗剂的作用。但是,目前尚没有可靠的方法来直接测量细胞中内源性G蛋白的活性。
(评论:这应该算首个可以检测的探针了 )
文章来源:Marcin Maziarz et al., Jong-Chan Park, Revealing the Activity of Trimeric G-proteins in Live Cells with a Versatile Biosensor Design. DOI: 10.1016/j.cell.2020.06.020 , Cell:最新IF:36.216
3、Genome Biology:新发现RNA聚合酶与染色质三维结构
2020年7月2日,来自北京大学生命科学学院季雄课题组在Genome Biology杂志在线发表了题为“Genome-wide analyses of chromatin interactions after the loss of Pol I, Pol II and Pol III”的研究论文。在该项研究中,作者运用改造的特异蛋白泛素化瞬时降解系统(degron),结合其实验室稍早前开发的高效的染色质高级结构解析技术BAT Hi-C ( Bridge linker-Alul-Tn5 Hi-C,系统阐述RNA聚合酶I/II/III (Pol I/II/III)对哺乳动物细胞染色质高级结构的直接和间接调控并且表明染色质三维结构相对稳定。
Pol I/II/III作为整个基因表达过程上游的核心因子,分别负责rRNA, mRNA,tRNA等的转录,这一过程需要协调大量的转录因子,它们既可能和染色质结构蛋白及非编码RNA互作从而直接组织染色质三维结构,也有可能通过转录下游效应间接发挥功能。为了回答这些问题,论文首先利用蛋白质瞬时降技术,在小鼠胚胎干细胞(mESCs)中特异性降解Pol I/II/III。结合BAT Hi-C技术,系统地描绘了RNA聚合酶降解前后染色质的三维结构图谱,并发现Pol I/II/III降解对TADs和Compartments等较大尺度的染色质结构高级结构影响有限。有趣的是,Pol II在细胞周期中的降解并不妨碍染色质高级结构的形成,表明转录不是三维染色质结构建立所必需的。
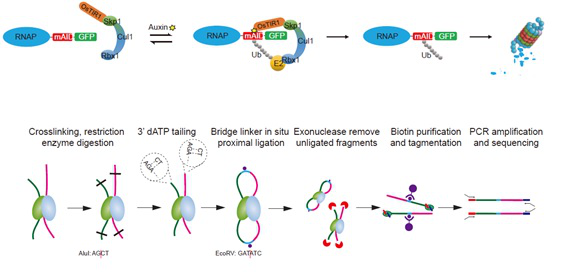
Fig 3. 蛋白质瞬时降解系统和BAT Hi-C的工作流程
结合更高精度的染色质结构解析技术(HiChIP, OCEAN-C),作者发现Pol II特异性降解对小尺度染色质结构的影响更为显著,通过分别分析Pol I/II/III降解前后高富集区的结构变化,发现Pol I/II/III在维持局部的精细染色质结构方面起到了一定的作用。随后在不同时间点降解Pol II处理,观察到长时间Pol II降解(>6 hr)会改变染色质的开放性和Cohesin蛋白在染色质上的结合,因此说明Pol II可以间接调控染色质的高级结构。综上所述,本工作系统地描述了哺乳动物细胞RNA聚合酶I/II/III (Pol I/II/III)对维持染色质三维结构的相对稳定起到了直接和间接的调控作用,为解析基因转录与染色质三维结构二者之间的关系提供了更准确的依据,也为研究其他因素对染色质高级结构的调控提供了新的思路。
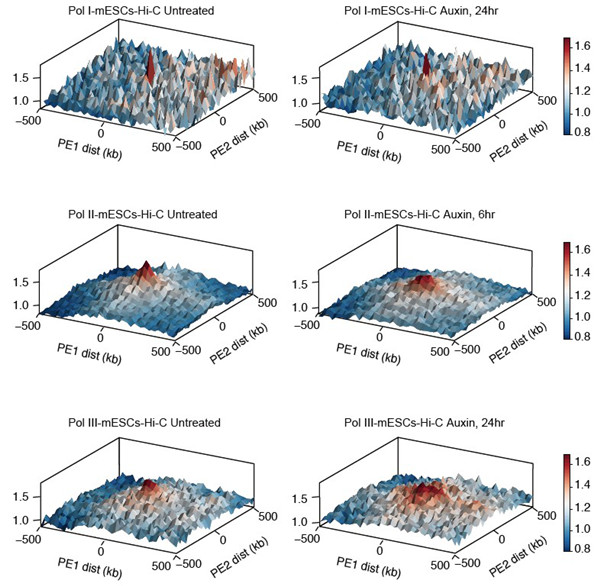
Fig 4. Pol I/II/III降解对各自高富集区的精细染色质结构造成影响
(评论:学习了 )
文章来源:
Yongpeng Jiang, Jie Huang et al, Genome-wide analyses of chromatin interactions after the loss of Pol I, Pol II, and Pol III. DOI: 10.1186/s13059-020-02067-3, Genome Biology