1.Science:施一公等揭示剪接体激活过程中结构重塑的分子机理
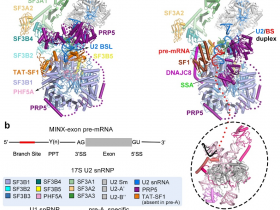
2020年11月27日,来自西湖大学施一公、万蕊雪等研究人员合作在学术期刊《科学》上发表了题为“Mechanism of spliceosome remodeling by the ATPase/helicase Prp2 and its coactivator Spp2.”的研究成果,报道了ATP酶/解旋酶Prp2及其共激活因子Spp2对剪接体重塑的机制。
研究人员报道了Prp2单独、Prp2与它的共激活因子Spp2结合和含有Prp2的活化剪接体结构,以及结构指导的生化分析结果。Prp2与剪接体弱结合,没有Spp2就无法发挥功能,而Spp2与Prp2和剪接体上的锚点稳定缔合,从而将Prp2束缚到激活的剪接体上并允许Prp2起作用。
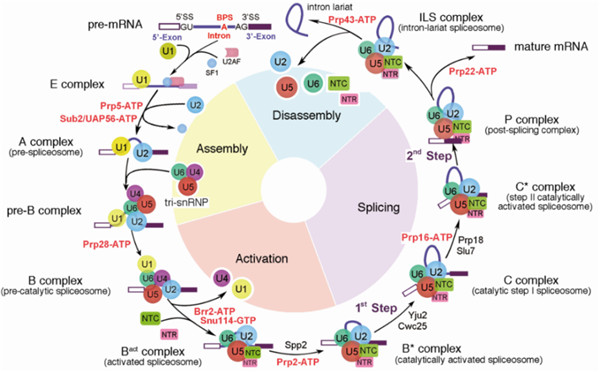
Fig1 | RNA剪接示意图
前体mRNA被加载到Prp2的N-和C-半之间的特征通道中,其中N-半的Leu536和C-半的Arg844阻止了前体mRNA向其5'端的向后滑动。ATP结合和水解触发Prp2中的域间移动,从而推动前体mRNA朝其3'端单向逐步转移。这些保守的机制解释了剪接体重塑与前体mRNA剪接的耦合。
据介绍,由保守的ATP酶/解璇酶(包括Prp2)执行的剪接体重塑可以实现前体mRNA的剪接。但是,ATP酶/解璇酶功能的结构基础仍然知之甚少。
(评论:作为第一篇剪接体重塑机制的结构研究,首次揭示了位于剪接体原位的 ATPase/helicase 高分辨率的三维结构,为理解剪接体激活重塑的分子机理提供了迄今最清晰的结构信息。)
文章来源:
Rui Bai, Ruixue Wan et al, Mechanism of spliceosome remodeling by the ATPase/helicase Prp2 and its coactivator Spp2. DOI: 10.1126/science.abe8863 Science:最新IF:41.037
2.Science:发现Rho让RNA聚合酶失活终止转录新机制
2020年11月26日,来自德国柏林自由大学Markus C. Wahl、美国俄亥俄州立大学Irina Artsimovitch研究组合作在《科学》杂志上发表了题为“Steps toward translocation-independent RNA polymerase inactivation by terminator ATPase ρ.”的最新进展。揭示通过终止子ATPase ρ进行不依赖于转运的RNA聚合酶失活的步骤。该项研究成果发表在出版的。
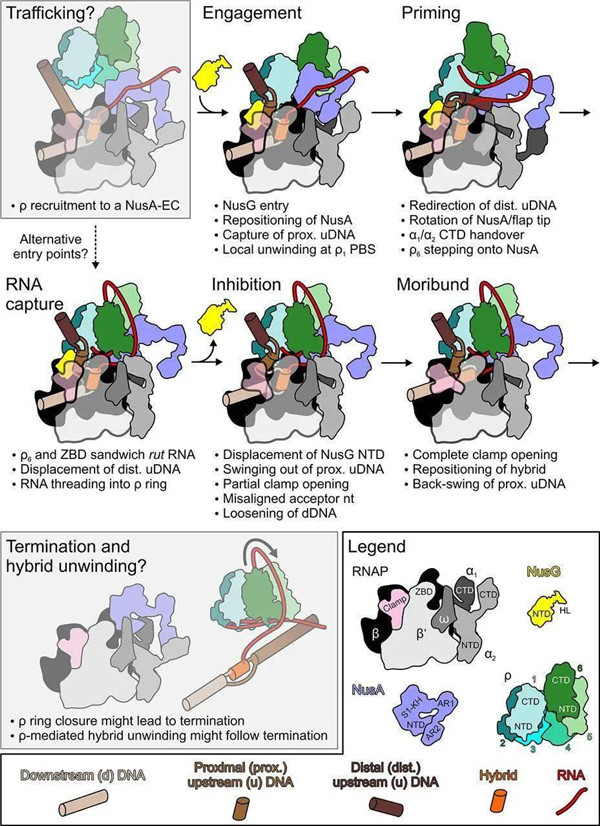
Fig 2|ρ介导的终止途径模型示意图
他们确定了一系列的冷冻电镜结构,描绘了终止NusA / NusG修饰的延伸复合物的路径上的六聚ATPase ρ。一个开放的ρ环接触NusA、NusG和RNA聚合酶的多个区域,捕获并局部打开近端上游DNA。NusA楔入ρ环,最初隔离RNA。在RNA聚合酶Zinc结合结构域上方偏转远端上游DNA后,NusA在一个加帽ρ亚基下方旋转,随后捕获RNA。
在NusG脱离捕获释放后,RNA聚合酶失去了对RNA:DNA杂合体的控制并被灭活。他们的结构和功能分析表明,整个生命周期中的ρ和其他终止因子可能利用类似的策略以构象方式捕获处于垂死状态的转录复合物。
(评论:这是一项会改写教科书的研究,使用低温电镜捕获了在他们的模式生物大肠杆菌的DNA模板上运行的RNA聚合酶的图像。这种高分辨率的可视化观察与高端计算相结合,使得对转录终止进行精确建模成为可能。)
文章来源:
Nelly Said, Tarek Hilal et al, Steps toward translocation-independent RNA polymerase inactivation by terminator ATPase ρ. DOI: 10.1126/science.abd1673, 最新IF:41.037
3.JCB:Katanin p60-like 1塑型力感受纤毛中细胞骨架
2020年12月2日,来自清华大学生命学院孙兰迪,崔立虹等在细胞生物学杂志上发表了题为“Katanin p60-like 1 Sculpts the Cytoskeleton in Mechanosensory Cilia.“的研究论文, 解析了机械力感受神经元中特化细胞骨架的三维结构,并初步揭示了其形成的分子机制。
机械力信号转导是细胞将胞外机械力信号转换为胞内信号的过程,它是触觉、痛觉、平衡觉等重要生理学过程的细胞生物学基础。在这一过程中,感受神经元中的力敏感离子通道可以将环境中的机械力刺激转换为电信号,而细胞膜和细胞骨架等支撑结构则决定了力信号转导的敏感性。研究人员在前序工作中发现果蝇I型机械力感受神经元树突顶端存在特化的纤毛结构,该结构中存在着由非中心体微管构成的高级细胞骨架结构,该结构具有结构支撑和力学感受双重功能。
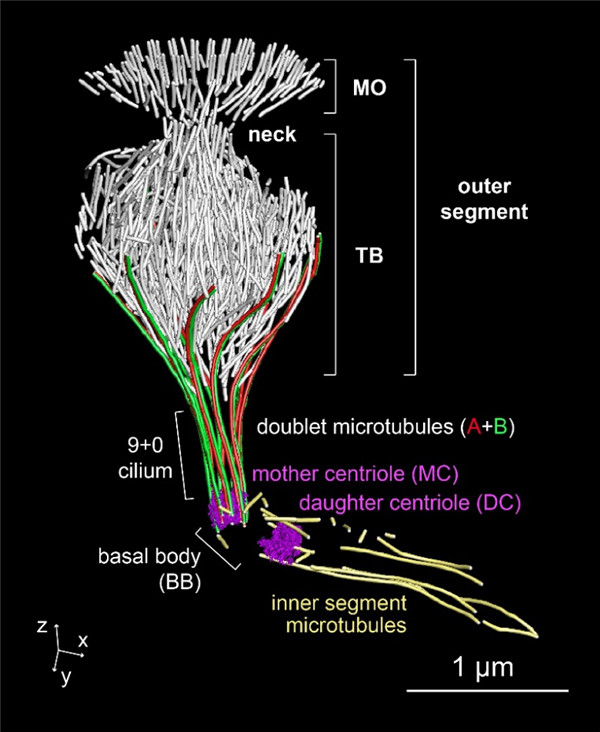
Fig 3|力感受神经元中特化纤毛内基于微管的细胞骨架三维结构
为深入了解上述细胞骨架的结构及其发生的分子机制,研究人员进一步应用基于电子断层成像的三维电镜重建技术在近分子水平的分辨率上原位解析了上述细胞骨架的高级结构,并结合活体细胞显微成像技术测量了微管纤维的极性、动力学及稳定性。接着,研究者们结合遗传学,行为学,单分子体外生化方法,电生理和在体钙成像功能分析等多种手段,发现微管切割蛋白Kat-60L1具有特异性的表达模式和空间定位,而且能够调控该类感受神经元对机械力信号响应的敏感性。进一步的结构和动力学分析表明,该分子通过与其它微管结合蛋白协同能够综合调控特化纤毛结构中微管的数量和长度,并进而精确调控了纤毛内特化微管细胞骨架的三维塑型,最终实现对整个纤毛结构形态及功能的最优化。
(评论:为进一步了解生物体感受机械力信号的分子基础打开了大门。同时,本工作也首次应用电子断层成像的方法对神经元树突末梢中高密度的骨架结构进行了在体原位分析,为解析该类复杂结构发生的分子机制提供了新的实验方法。以该工作为基础)
文章来源:
Landi Sun, Lihong Cui, Zhen Liu et al, Katanin p60-like 1 sculpts the cytoskeleton in mechanosensory cilia.doi.org/10.1083/jcb.202004184