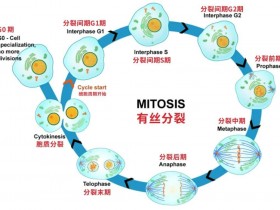
1.Nature:发现惊人机制:让免疫系统找到癌症干细胞
近日,来自巴塞尔大学等多处的科学家在《Nature》杂志上发表了题为“Absence of NKG2D ligands defines leukaemia stem cells and mediates their immune evasion.”的研究论文,报道了癌症干细胞如何巧妙地欺骗免疫系统的机制。
白血病干细胞能通过抑制杀伤细胞的靶分子来保护自身免受免疫细胞的攻击。这种保护机制可以被药物“欺骗”。
急性髓性白血病(AML)患者在成功治疗后经常会复发。在治疗中存活的白血病干细胞是疾病复发的原因。科学家对此的解释是:干细胞具有保护机制,使其对化疗产生抗性。但是它们是如何摆脱免疫防御的呢?
来自巴塞尔大学和蒂宾根大学,德国癌症研究中心(DKFZ)和德国癌症联盟(DKTK)等处的科学家深入分析了这一现象,发现了一个惊人的机制。
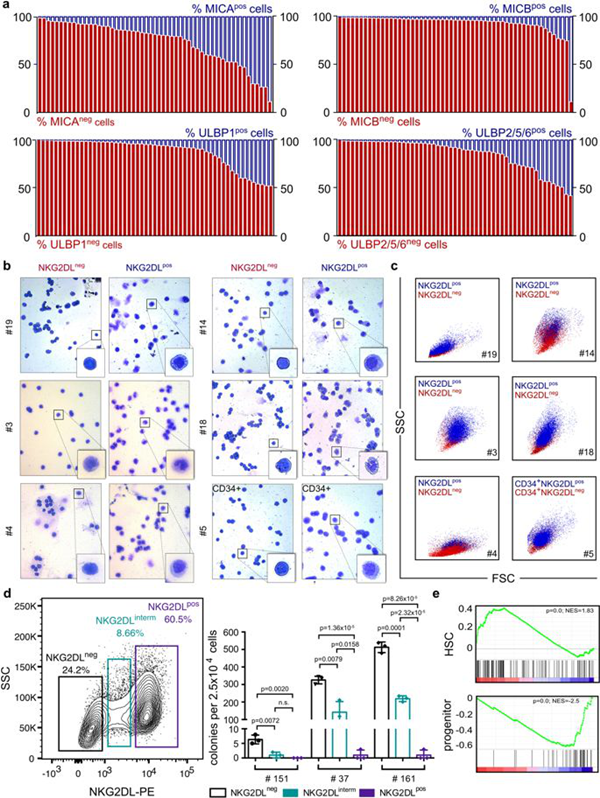
研究人员分析了175名AML患者的白血病细胞,发现癌症干细胞可以抑制其表面的NKG2D-L蛋白。这些蛋白质是自然杀伤细胞(NK细胞)识别受损和感染细胞以及癌细胞的依据,从而在必要时杀死它们。通过这种方式,白血病干细胞逃避了免疫系统的攻击。另一方面,没有干细胞特性的白血病细胞在其表面上呈递这些靶分子,因此逃脱了NK细胞的检查。
在注入了患者AML细胞的小鼠中,研究人员发现虽然正常的AML细胞(没有干细胞特性)受NK细胞控制,但NKG2D-L阴性白血病干细胞能逃过“杀手小队”。
文章作者,巴塞尔大学Claudia Lengerke说:“干细胞特性与逃避免疫系统的能力之间的这种联系到现在还不得而知。白血病干细胞中这种免疫抗性的一个重要机制显然是与抑制细胞表面的NKG2D-L等危险信号有关。”
(图1 |来源nature)
这种惊人的保护机制背后是什么?
研究人员注意到白血病干细胞产生了特别多的PARP1,这种酶显然可以阻止NKG2D-L的产生。小鼠临床前实验表明,PARP1实际上在免疫逃逸中发挥重要作用:如果这些动物用抑制PARP1的药物治疗,白血病干细胞再次在其表面表达NKG2D-L,然后由NK细胞识别和消除。
目前,癌症免疫疗法已经在某些疾病情况下以AML患者的同种异体干细胞移植的形式成功应用多年。近年来,科学家门开发了进一步的新型免疫治疗方法,目前正在临床上进行测试。
(评论:从这机制中得出新的免疫治疗方法,未来根治也是指日可待)
文章来源:
Paczulla AM, Rothfelder K, Raffel S, et al. Absence of NKG2D ligands defines leukaemia stem cells and mediates their immune evasion. Nature. 2019 Jul 17.
近日,来自蒙特利尔研究小组在《Nature》杂志上发表了题为“Intestinal infection triggers Parkinson's disease-like symptoms in Pink1-/- mice. ”的研究论文,发现肠道轴在帕金森的相关性。
帕金森病是一种神经退行性疾病,其运动症状与黑质致密部中多巴胺能神经元的丧失有关。尽管至今为止,引发多巴胺能神经元丧失的机制尚不清楚,但线粒体功能障碍和炎症被认为具有关键作用。
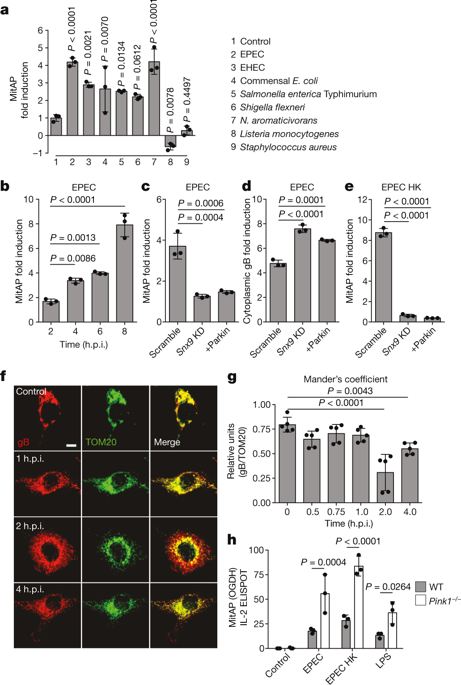
(图2 |来源nature)
早期发作的帕金森病与PINK1激酶和PRKN泛素连接酶基因的突变有关。 PINK1和Parkin(由PRKN编码)参与培养细胞中受损线粒体的清除,但最近使用敲除和敲入小鼠模型获得的证据显示出了关于PINK1和Parkin对体内线粒体自噬的贡献的矛盾结果。
研究人员先前已经证明,PINK1和Parkin通过抑制线粒体抗原的呈递在适应性免疫中起关键作用,这表明自身免疫机制参与了帕金森病的病因学。
研究人员又发现,Pink1 - / - 小鼠中的革兰氏阴性细菌的肠道感染参与线粒体抗原呈递和自身免疫机制,其在外周和脑中建立细胞毒性线粒体特异性CD8 T细胞。
值得注意的是,这些小鼠显示纹状体中多巴胺突触的密度急剧下降,并且受到运动损伤的影响,用L-DOPA治疗后逆转。
这些数据支持了PINK1是免疫系统抑制因子的观点,并提供了一种病理生理模型,其中肠道感染是帕金森病的一个触发事件,突出了肠道轴在疾病中的相关性。
(评论:难道真的跟肠道感染有关?)
文章来源:
Matheoud D et al. Intestinal infection triggers Parkinson's disease-like symptoms in Pink1-/- mice. NATURE, 2019; doi: 10.1038/s41586-019-1405-y.
3.nature:慢性病毒感染期间,CD8+ T细胞可诱导恶病质
近日,来自奥地利科学院分子医学CeMM研究中心Andreas Bergthaler研究小组在《Nature Immunology》上发表了题为“CD8 + T cells induce cachexia during chronic viral infection.”得新成果,研究探明了CD8+ T细胞在慢性病毒感染过程中诱导产生恶病质。
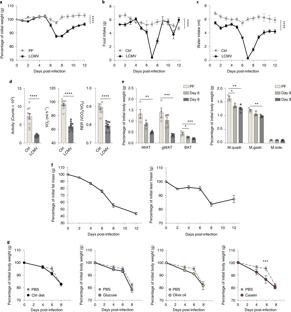
(图3 | 来源nature 感染LCMV克隆13导致瞬时恶病质)
课题组研究人员描述了慢性病毒感染小鼠可逆性恶病质模型,并鉴定了CD8阳性T细胞在IAC中的重要作用。与癌症相关的恶病质相关细胞因子不参与IAC。相反,病毒特异性CD8+T细胞引起脂肪组织的形态学和分子变化,导致脂质储存的减少。这些变化发生在CD+8T细胞反应峰值之前的一个时间点,需要T细胞固有的I型干扰素信号和抗原的特异性启动。研究结果将全身抗病毒免疫反应与脂肪组织重塑联系起来,揭示了CD8+T细胞在IAC中的未被重视的作用。
据介绍,恶病质是各种癌症、慢性炎症和感染的发病率和死亡率的主要原因。然而对引起恶病质机制的理解仍然有限,尤其是对感染相关恶病质(IAC)的理解。
(评论:本实验多次运用了ELISA试剂盒进行检测,其中亚科因生物(Abbkine)的ELIKINETM试剂盒作为一个重点检测指标来使用,即:KTE0004检测小鼠血液中的游离甲状腺素,使用方法便捷,效果卓越。)
文章来源:
Andreas Bergthaler et al. CD8 + T cells induce cachexia during chronic viral infection.DOI: 10.1038/s41590-019-0397-y