对于您的超分辨成像研究,有什么比顶级质量的一抗更好呢?这些一抗经世界各地知名研究人员验证,结合高质量染料,专门设计以完美满足STED超分辨显微镜的特定要求。在这里,SYSY呈现了在神经科学领域中最广泛使用的SYSY一抗系列,直接与匹配的abberior STAR染料偶联,经过优化以适用于STED显微镜。
简介
揭示突触的结构和功能长期以来取得了成功。然而,传统显微技术中的衍射限制了分辨率,从而限制了对突触结构和功能的洞察。超分辨显微镜技术实现了前所未有的精度,可以可视化突触结构。这种能力转变了我们检查突触间隙、活跃区和 postsynaptic 密度内蛋白质的空间组织的能力,可以极为详细地展示。它促进了对分子水平上突触组分的异质性和动态性的研究。
 |
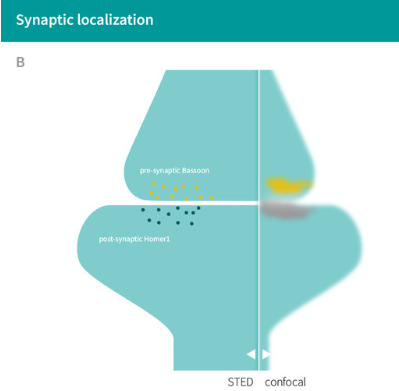 |
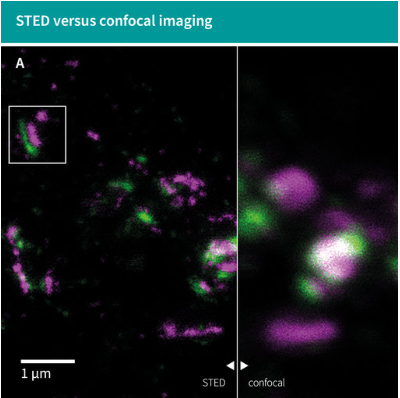
| Figure 1A: Pre-synaptic Bassoon labeled with abberior STAR RED and post-synaptic Homer1 labeled with abberior STAR ORANGE show well-separated synaptic structures using STED microscopy. | Figure 1B: Schematic illustration of the synaptic localization of Bassoon and Homer1. |
神经递质/化学突触的结构
神经元必须快速而准确地传递信息;它们负责从我们身体各个部位,从脚趾尖到大脑,迅速传递信号,然后在大脑中处理这些信息。为了实现如此快速和精准的沟通,突触优化其处理高需求和间歇信号处理的能力。
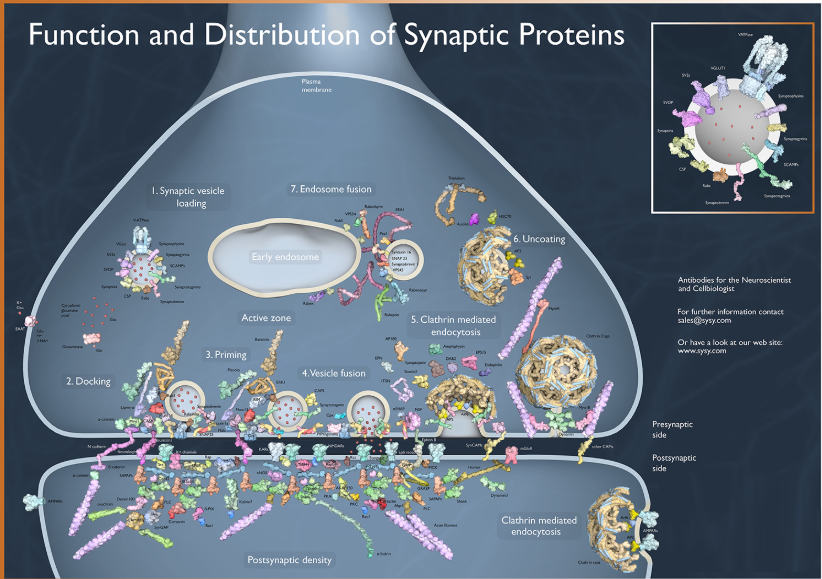
化学突触是脊椎动物中主要发现的一种突触类型,是一个不连续的结构,由一个突触前神经元和一个突触后神经元组成,它们之间被大约15-20纳米宽的突触间隙分隔。化学突触中的信号传递是通过突触囊循环进行的。突触囊和活跃区中发现的专门蛋白质在协调突触囊循环中起着关键作用。SNARE蛋白,如Syntaxin、Synaptobrevin和SNAP-25,参与了突触囊与质膜的融合。像Bassoon、Piccolo和RIM这样的支架蛋白组织和招募突触囊靠近质膜。Synapsins通过与细胞骨架蛋白结合帮助突触囊的移动,而complexins防止囊泡的自发融合。此外,CAPS(钙激活分泌蛋白)促进了钙信号与突触囊融合的耦合(Chua等,2010年;Jahn和Fasshauer,2012年)。
突触后密度(PSD)是一个富含蛋白质的特殊区域,对于接收来自突触前神经元的神经递质信号并启动突触后反应至关重要。PSD中丰富的是神经递质受体,每个突触中主要由突触前神经元释放的神经递质决定。这种受体释放的神经递质配对决定了每个特定突触的电学特性。此外,各类支架蛋白,如PSD-95、Shank和Homer,在锚定和组织信号分子、受体和结构蛋白在突触后密度中发挥关键作用(Takamori等,2006年;Chua等,2010年)。
突触间隙主要充满细胞外基质和其他非蛋白成分。其中包括细胞粘附分子,如cadherins、integrins、neuroligins(存在于突触后膜中)和neurexins(存在于突触前膜中)。它们共同介导突触粘附,并在突触形成和功能中发挥作用。额外的细胞外基质蛋白如laminins、collagens和proteoglycans有助于组织和稳定突触连接(Dankovich和Rizzoli,2022年)。
显微镜技术的进步,特别是超分辨技术,使我们能够以惊人的细节观察突触。这些技术使科学家能够观察特定蛋白质相互作用以及突触和突触囊的异质性,大大加深了我们对这些复杂生物结构的理解(Binotti等,2024年;Upmanyu等,2022年;Nishimune等,2016年;Willig等,2006年)。然而,许多突触结构和功能方面仍未解决。例如,前突触活跃区(AZ)的精细结构,分子簇的重要性以及突触囊循环背后的动态和分子机制仍未完全描述(Nosov等,2020年)。
STED显微镜
在纳米级光显微镜技术出现之前,特别是STED(受激发射消融)显微镜技术的发展之前,研究人员受到传统光显微镜的衍射限制。这个限制将分辨率限制在大约200-300纳米横向和约500-700纳米轴向。STED显微镜的概念由Stefan Hell和Jan Wichmann于1994年提出,并于2000年进行了实验验证(Hell和Wichmann,1994年,Klar等,2000年)。STED显微镜基于传统共焦激光扫描配置,但除了一个激发激光外,还包括一个第二个红移和环形STED激光,其中心为零强度。这样,除了环形中心的分子外,所有分子都被消融。这种配置确保了由中央光束激发的荧光分子会被STED光束迅速去激发,而来自STED环形中心的任何荧光则得以保留。荧光信号被锐化,达到了30-70纳米的横向分辨率。衍射屏障被突破。
成功进行STED成像的先决条件
良好的成像结果取决于两个条件:良好的荧光染料和特异性抗体。用于STED的理想荧光探针必须具备几个关键属性:对STED光束的响应以实现高效去激发、优化的吸收和发射光谱与STED系统中可用的激光线匹配、在反复激发和去激发循环中耐光漂白。为了实现最佳的STED成像效果,STED染料的先驱公司abberior提供了经过特别优化的荧光染料。以其卓越的光稳定性、定制的光谱特性、高效的去激发能力、高量子产额、与生物样品兼容性以及最小的背景噪音而闻名,abberior STAR ORANGE和STAR RED是775纳米双色STED的完美组合。 在STED显微镜中实现高空间分辨率,所使用的用于染色活体或固定样本的抗体的选择至关重要。SYSY抗体具有高特异性和亲和力,使其成为您显微镜分析的精确而强大的工具。使用经过充分表征的单克隆抗体,具有高特异性结合到单一抗原表位,可以减少染色模式的变异性,减少与其他蛋白质或分子的交叉反应的可能性。
直接偶联的优势
与使用标记的二抗间接标记相比,直接偶联显示出一系列重大优势。除了消除对二抗的需求外,直接偶联还减少了空间位阻,这在间接标记中可能降低了一抗对靶标的亲和力和特异性。此外,通过减少非特异性二级结合到非靶蛋白(交叉反应)的背景噪音,减少了荧光团与抗原之间的距离,并防止多个二级抗体结合到单个一级抗体而掩盖单个分子的空间排列(Früh等,2021年)。
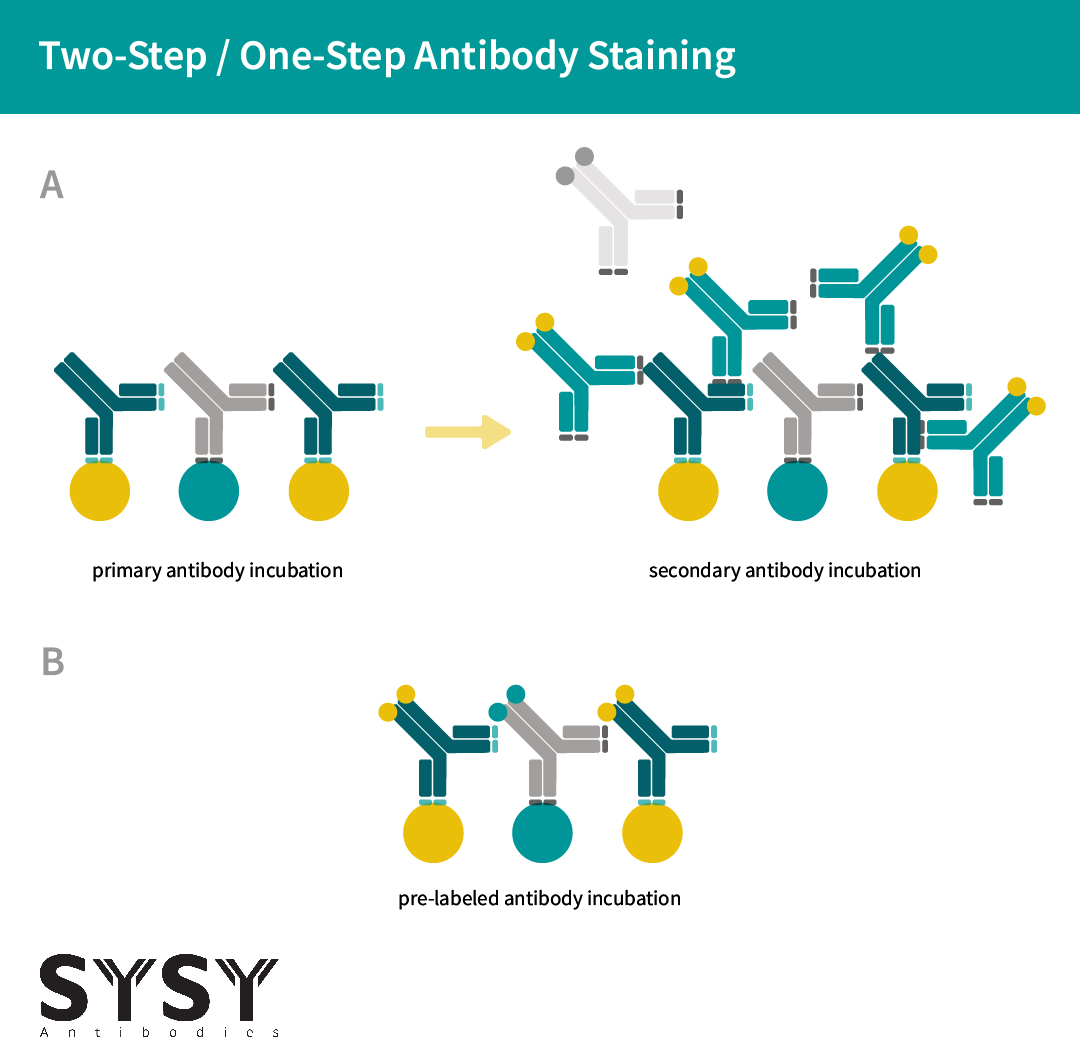
Figure 3: 一抗的直接偶联(一步,B)减少了空间位阻、荧光团距离和表位掩蔽,这可能使用耗时的二抗两步染色(A)发生。
使用与abberior STAR染料结合的SYSY原代抗体,进一步提升您的STED显微镜体验。
SYSY抗体符合STED超分辨显微镜的特定要求。
| 货号 | 产品名称 | 应用 | 规格 |
| 141-111AbOR | Bassoon, mouse, monoclonal, purified IgG, AbberiorStar ORANGE K.O. |
ICC | 100 µg |
| 141-111AbRED | Bassoon, mouse, monoclonal, purified IgG, AbberiorStar RED K.O. |
ICC | 100 µg |
| 160-111AbOR | Homer1b/c, mouse, monoclonal, purified IgG, AbberiorStar ORANGE |
ICC | 100 µg |
| 160-111AbRED | Homer1b/c, mouse, monoclonal, purified IgG, AbberiorStar RED |
ICC | 100 µg |
| 162-311AbOR | Shank3, mouse, monoclonal, purified IgG, AbberiorStar ORANGE |
ICC | 100 µg |
| 162-311AbRED | Shank3, mouse, monoclonal, purified IgG, AbberiorStar RED |
ICC | 100 µg |
| 106-011AbOR | Synapsin1, mouse, monoclonal, purified IgG, AbberiorStar ORANGE K.O. |
ICC | 100 µg |
| 106-011AbRED | Synapsin1, mouse, monoclonal, purified IgG, AbberiorStar RED K.O. |
ICC | 100 µg |
| 104 211AbOR | Synaptobrevin2, mouse, monoclonal, purified IgG, AbberiorStar ORANGE K.O. K.D. |
ICC | 50 µg |
| 104-211AbRED | Synaptobrevin2, mouse, monoclonal, purified IgG, AbberiorStar RED K.O. K.D. |
ICC | 50 µg |
| 101-011AbOR | Synaptophysin1, mouse, monoclonal, purified IgG, AbberiorStar ORANGE K.O. K.D. |
ICC | 50 µg |
| 101-011AbRED | Synaptophysin1, mouse, monoclonal, purified IgG, AbberiorStar RED K.O. K.D. |
ICC | 50 µg |
| 105-011AbOR | Synaptotagmin1, mouse, monoclonal, purified IgG, AbberiorStar ORANGE K.O. K.D. |
ICC | 100 µg |
| 105-011AbRED | Synaptotagmin1, mouse, monoclonal, purified IgG, AbberiorStar RED K.O. K.D. |
ICC | 100 µg |
引用:
Binotti et al., 2024: ATG9 resides on a unique population of small vesicles in presynaptic nerve terminals. PMID: 37881948
Chua et al., 2010: The architecture of an excitatory synapse. PMID: 20200227
Dankovich and Rizzoli, 2022: The Synaptic Extracellular Matrix: Long-Lived, Stable, and Still Remarkably Dynamic. PMID: 35350469
Früh et al., 2021: Site-Specifically-Labeled Antibodies for Super-Resolution Microscopy Reveal In Situ Linkage Errors. PMID: 34184536
Hell and Wichmann, 1994: Breaking the diffraction resolution limit by stimulated emission: stimulated-emission-depletion fluorescence microscopy. PMID: 19844443
Jahn and Fasshauer 2012: Molecular machines governing exocytosis of synaptic vesicles. PMID: 23060190
Klar et al., 2000: Fluorescence microscopy with diffraction resolution barrier broken by stimulated emission. PMID: 10899992
Nishimune et al., 2016: Dual-color STED microscopy reveals a sandwich structure of Bassoon and Piccolo in active zones of adult and aged mice. PMID: 27321892
Nosov et al., 2020: The Decade of Super-Resolution Microscopy of the Presynapse. PMID: 32848695
Takamori et al., 2006: Molecular anatomy of a trafficking organelle. PMID: 17110340
Upmanyu et al., 2022: Colocalization of different neurotransmitter transporters on synaptic vesicles is sparse except for VGLUT1 and ZnT3. PMID: 35263617
Willig et al., 2006: STED microscopy reveals that synaptotagmin remains clustered after synaptic vesicle exocytosis. PMID: 16612384






