在前面的《疾病中的性别歧视,看完扎心了》一文中,我们给大家介绍了一些疾病存在明显的性别差异,这种性别差异对疾病诊断及管理都非常重要,甚至会影响预后。因此我们在统计学分析时,也常常需要对性别这样的因素进行校正。今天,我们再来说说现在大家都很关心的新型冠状病毒肺炎方面的性别差异,还有大家恐怕不会想到的,在基因表达、昼夜节律方面男女也存在差异哦。
图片来源:360图片
一、新冠病毒对人的感染,存在性别差异吗?
在疫情中,一个引人关注的话题是:基于男女的性别不同,以及由此而来的人体构造和生物层面的巨大差异,是否会对新冠肺炎的感染情况造成差异性的影响。现在,关于这个问题,有了更清晰、更具说服力的的答案。看看一项针对 77932 例患者的荟萃分析:
3 月 30 日,在论文预印本网站 ArXiv 上,出现了一篇标题为 Sex Differences in Severity and Mortality Among Patients With COVID-19: Evidence from PoOLEDLiterature Analysis and Insights from Integrated Bioinformatic Analysism 的研究论文。这篇论文是由来自上海长海医院的任善成教授团队发表的,文章(共同)作者为魏希夷、肖雨田、王建、陈锐、张威等。该论文试图通过汇集的文献分析的证据,以及来自综合性生物信息分析的洞察,来探寻 COVID-19患者严重程度和死亡率的性别差异。可以说,这是按照荟萃分析(Meta-Analysis,一种将多项研究结果进行定量合成分析的统计学方法)和系统回顾的要求,完成的首个针对新冠肺炎发病率/重症率/死亡率与男女性别相关性的大数据分析研究。
根据 BioArtReports 对论文的报道,该研究搜索到了包括预印版文章在内的共 1561 篇文献(截止日期为 2020 年 3 月 19 日),经过多人独立筛选后,最终有 39 项研究共 77932 例患者纳入荟萃分析,其中男性为 41510 例,占比 53.3%,所有病例均来自于中国和日本、韩国、新加坡、意大利、英国等六个国家。结果显示,在所有病例的 39 项总体研究中,新冠病毒的男性发病率要显著高于女性,其中来自中国人群的 34 项研究更是支持这一结论。同时,共有 21 项和 8 项研究分别报告了重症病例(包括 ICU 患者,ARDS 患者,重症患者)数量和死亡病例数量,荟萃分析结果显示:男性人群的重症率和病死率同样显著高于女性。进一步的亚组分析还发现,在平均年龄小于 50 岁的患病人群中,不同性别患者的重症比例差异并不明显;而在平均年龄大于 50 岁的患病人群中,男性患者的重症率要显著高于女性患者。由上述亚组分析可见,随着患者年龄越大,男性的重症比例要越高于女性,从而提示医护人员在救治新冠肺炎患者的过程中应当更多的关注中老年男性人群。总体来看,文章认为,新型冠状病毒肺炎在男性群体中的发病率、重症率、和死亡率均要高于女性群体。
那么,新冠肺炎为什么会出现 “男女有别” 的情况呢?其实我们前面的《疾病中的性别歧视,看完扎心了》一文已经给出了一点线索:物种的生存意味着男性更容易被病毒入侵感染,但女性机体反应性较强的免疫系统却会让其对自身免疫疾病和过敏症变得敏感。相比女性而言,男性死于感染性疾病的数量明显高于前者。
再来看看最新的研究:
研究人员发现,新型冠状病毒感染人体细胞的关键,在于冠状病毒的 S 蛋白(Spike Glycoprotein,刺突糖蛋白)与人体中的 ACE2 蛋白(Angiotensin-converting enzyme 2,中文全称为血管紧张素转化酶 2)的结合——准确地说,是病毒的 S 蛋白“劫持” 了原本是控制血压的 ACE2,通过与它的结合入侵人体并诱发感染。
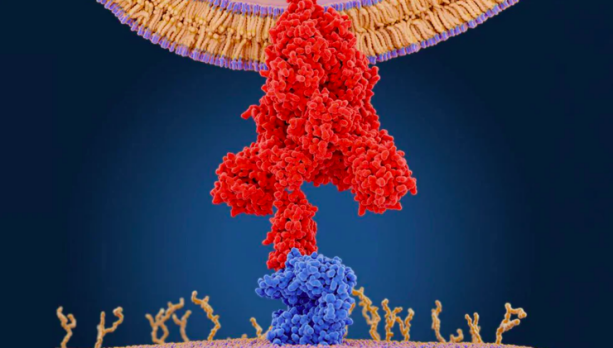
然而,根据 Cell 杂志在 3 月发布的研究成果,新冠病毒(SARS-CoV-2)在激活其 S 蛋白的过程中,需要利用人体细胞中的一种蛋白酶——也就是丝氨酸蛋白酶 TMPRSS2。此处的重点在于:TMPRSS2 作为促进男性前列腺癌发生的关键分子,受到人体内雄激素的正向调控——由此,任善成教授团队认为,造成新冠肺炎 “男女有别” 的重要因素,是男性体内较高的雄激素水平及其对病毒入侵关键分子的调控。研究者通过对肺部单细胞测序数据以及其它重要数据库的分析发现了几个与 SARS-CoV-2 病毒感染相关的肺部 ACE2 关键特征。
1、单细胞 RNA-seq 分析显示,能够表达 ACE2 的 II 型肺泡细胞(AT2)在男性肺部中的数量要显著高于女性,也就是说病毒可以攻击的宿主细胞数量在男性中要比女性多;同时,前列腺和睾丸的单细胞 RNA-seq 数据发现 ACE2 在这两个男性特有器官中普遍表达,提示前列腺和睾丸可能是 SARS-Cov-2 感染男性人群的潜在目标。
2、雄激素受体可以直接正向调控ACE2的表达。分析发现,雄激素受体(AR)与 ACE2 呈共表达模式;进一步分析发现,雄激素受体与 ACE2 和 TMPRSS2 的表达呈正相关这一现象,普遍存在于人体的多个组织器官中,而雄激素被剥夺之后,ACE2 和 TMPRSS2 的表达也随之下调;另外,进一步提示雄激素受体可能与 ACE2 上游的增强子区域结合而促进 ACE2 的表达。
3、分析发现,不少促炎细胞因子和趋化因子在男性人群中呈现优势表达,特别是“细胞因子风暴”的核心因子 IL‐6 的受体 IL6ST 在男性肺部多个细胞中高表达,提示男性更易发生“细胞因子风暴”而导致新冠肺炎病情恶化。而一些针对病毒感染发挥保护作用的 CCL2,CCL3,CCL4 等细胞因子则在女性人群中呈高表达。
4、男性肺部微环境中 T 细胞(可发挥细胞免疫及免疫调节等功能)相较于女性对病毒杀伤能力更弱。这种基于性别的天然免疫反应差异导致了男性肺部细胞抵抗病毒攻击的能力弱于女性。
以上四点结合起来,就客观上解释了男性新冠肺炎的发病率和死亡率均要高于女性的生物学原因。BioArtReports 表示,这项研究首次通过大样本荟萃分析清晰证实了男性在新冠肺炎的发病率、重症率、以及死亡率上均要高于女性。同时,它还揭露了背后的生物学原因,证明了新冠病毒入侵的关键分子 ACE2 因受到雄激素受体的正向调控,在男性肺细胞的表达和分布要高于女性;以及男性肺细胞受到病毒攻击时自身免疫反应相较于女性更弱等特征。
这些都指向了一个简单的结论:在新冠病毒面前,男性比女性更加脆弱。也就是说,男性不仅更容易感染新冠病毒,而且似乎症状更严重。
二.为啥男性更多“夜猫子”?原来生物钟有性别差异
昼夜节律,即我们常说的生物钟,已得到科学家的广泛研究。昼夜节律赋予了人类行为和生理学的时间模式,使身体内在与外在环境的预期变化保持一致。被扰乱的昼夜节律会对健康产生影响。然而,在大量的研究中很少有关注昼夜节律在性别间的差异。
北京时间9月5日,发表在《Science》上的一篇综述文章中,来自美国宾夕法尼亚大学的两名研究人员在分析了大量昼夜节律的研究后发现了一个模式:昼夜节律存在性别差异。DOI:10.1126/science.abd4964
先前的研究发现,相比于其他动物,人类的身体节律不止一种。除了调节睡眠和清醒的昼夜节律外,人类还有控制呼吸、皮肤和心率的节律等。昼夜节律是最为人所熟知的,因为它对我们的日常生活有着显著影响。它控制着我们什么时候睡觉,什么时候醒来;而且,它还参与新陈代谢。在这项新研究中,宾夕法尼亚大学佩雷尔曼医学院转化医学与治疗学研究所的Garret FitzGerald与SeánT. Anderson希望通过分析那些直接研究昼夜节律对人类影响的论文来更多地了解昼夜节律。
这项涉及对超过53000参与者的记时型或昼夜偏好的研究强调了年龄和性别对昼夜节律的影响。他们发现年龄和性别确实存在昼夜节律差异。儿童通常是早起的,不分性别,但青春期后性别间的差异开始产生。
具体而言,研究人员发现:女性一般都是早起的人,而男性则更倾向于晚睡;女性更能适应昼夜节律中断所带来的影响;女性在白天比男性更活跃,这种模式在儿童中也很常见;在晚上,女性不如男性精力充沛。
他们还发现,与男性相比,女性花费在睡觉上的时间更多,而在睡眠过程中,女性的慢波深度睡眠时间也比男性多,而且也更能适应外界干扰。男性呢,则午睡的可能性更大。
研究人员并没有找到导致两性昼夜节律差异的原因,但怀疑这与传统上女性扮演母亲的角色有关,对她们来说,有一个与后代一致的昼夜节律似乎是自然而然的事情。
三、基因表达,男女有别
我们知道,基因与疾病和健康息息相关,全基因组关联研究已经发现了无数与疾病有关的突变位点。为了弄清楚基因表达奥秘,2010年,一项名为基因型组织表达(GTEx)的项目启动了。该项目收集了来自近1000个个体的54个组织的未患病样品,试图通过分子测定阐明基因组表达调控和遗传变异之间的秘密。就在最近,GTEx计划公布了第三阶段、也是最后一阶段的分析成果,数据以系列论文的形式发表,获得了《科学》杂志的封面报道。
下面我们来看与性别相关的发现:
在44个男女均有的组织中,几乎都有基因在两性之间,存在表达水平的不同。研究者鉴定出了369种男女有别的调控基因,它们的分布与组织特异性存在关联,大部分发现于乳房,肌肉、皮肤、脂肪组织中也比较常见。特别值得注意的是,有些差异信号似乎只在单个性别中存在。比如说在骨骼肌中鉴定到的rs2273535突变与癌基因AURKA调控有关,但是这种关联仅存在于男性当中。对来自不同种族供体样本的分析也显示,基因变体对不同族群的表达调控影响是不同的。
其次,研究者对比了不同组织之间的差异,发现表达调控效应并不一致,大脑、睾丸、淋巴母细胞系、血液以及肝脏尤为特殊,其他大多数组织器官则比较相似。这意味着,在对遗传调控的研究上,血液并不能很好地代表其他组织,皮肤反而可能是更好的选择。研究者也分析了不同细胞类型中的差异,表明组织间共享的细胞类型可能是组织间相同遗传调控作用的基础。
最后,研究者还对单一变异表现出的多种调节效应进行了分析,提出遗传效应的复杂多效性机制,单个突变可以表现出对多个组织的调节作用,并转化为不同的生理特征。
咋样,很神奇吧?我们以后继续带领大家领略生命科学的各种奇妙之处!