1、Cell:研究单RNA病毒的翻译和复制动态新方法
11月13日,来自荷兰胡布勒支研究所和乌德勒支大学的研究人员在《Cell》杂志上发表了题为“Translation and Replication Dynamics of Single RNA Viruses.”的研究结果,发出一种先进技术来实时监控病毒感染。这种称为VIRIM(病毒感染实时成像)的新技术有助于了解病毒如何感染人体,最终有望促成靶向疗法的开发。
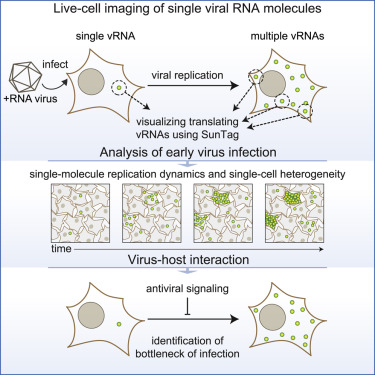
Fig1 |来源CELL
研究人员开发了一种单分子成像测定法,即病毒感染实时成像(VIRIM),能够研究活细胞中单个RNA病毒的翻译和复制。VIRIM在细胞之间的复制动力学中发现了惊人的异质性,并揭示了单个病毒RNA的翻译和复制之间的广泛协调。
此外,使用VIRIM,研究人员将传入病毒RNA的复制步骤确定为成功感染的主要瓶颈,并确定了负责抑制早期病毒复制的宿主基因。病毒感染的单分子成像是研究病毒复制和病毒-宿主相互作用的强大工具,可广泛应用于RNA病毒。
(评论:利用这种技术来对付许多威胁生命的病毒,包括新冠病毒SARS-CoV-2。)
文章来源:
Sanne Boersma,Huib H. Rabouw et al,Translation and Replication Dynamics of Single RNA Viruses. doi.org/10.1016/j.cell.2020.10.019
2、Science:两大重要图谱-解释人类细胞生长和发育
11月13日,来自华盛顿大学Brotman Baty研究所的UW Medicine研究人员在Science杂志上发表了题为“A Human Cell Atlas of Fetal Gene Expression”;“A Human Cell Atlas of Chromatin Accessibility”的研究成果。研究人员发布了两大重要图谱,一个图谱定位了15个胎儿组织中单个细胞内的基因表达;第二个图谱描绘了细胞内单个基因的染色质可及性。
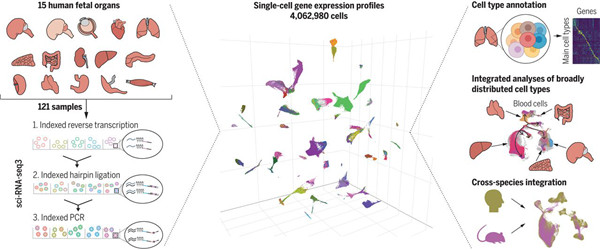
Fig2 |来源Science
针对基因表达图谱上,研究人员采用了一种称为sci-RNA-seq3的技术,在15种类型的胎儿组织中分析了基因表达。这项技术用三个DNA“条形码”的独特组合标记每个细胞,从而使研究人员无需物理分离即可跟踪细胞。
一旦获得序列,研究人员就使用计算机算法来恢复单细胞信息,按类型和亚型对细胞进行聚类,并确定它们的发育轨迹。科学家们分析了超过400万个单细胞,并鉴定出77种主要细胞类型和大约650种细胞亚型。
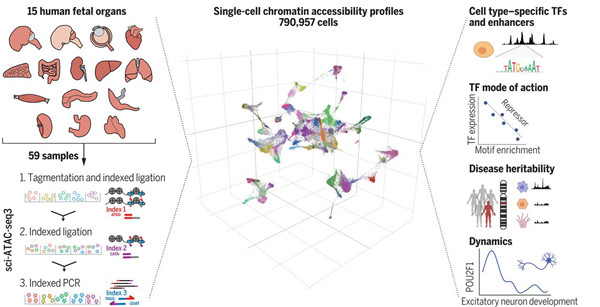
Fig3 |来源Science
针对染色质可及性图谱,科学家们开发了一种称为sci-ATAC-seq3的新方法来描述单个细胞中DNA的可及性,像sci-RNA-seq3一样,这一方法也在每个细胞中使用三种不同的DNA“条形码”来标记和跟踪单个细胞。但是,sci-ATAC-seq3并不是识别所有当前表达的序列,而是捕获并打开了染色质位点。
在这项研究中,科学家在15个胎儿组织的约100万个位置上生成了近80万个单细胞染色质可及性概况。他们解析了哪些蛋白质可能与每个细胞中的可及DNA位点相互作用,以及这些相互作用如何影响细胞类型。
(评论:这些图谱可以提供了许多细胞类型的信息,告诉我们基因组的哪些部分可能起作用,以及探索哪些是参与了基因调控。)
文章来源:
Junyue Cao, Diana R. O’Day, et al.A Human Cell Atlas of Fetal Gene Expression;Silvia Domcke, Andrew J. Hill et al, A Human Cell Atlas of .
3、Nature:人类40S核糖体成熟最终步骤的结构基础
2020年11月18日,来自德国慕尼黑大学Roland Beckmann研究组在《自然》杂志发表了题为“Structural basis for the final steps of human 40S ribosome maturation.”的研究成果,报道人类40S核糖体成熟最终步骤的结构基础。
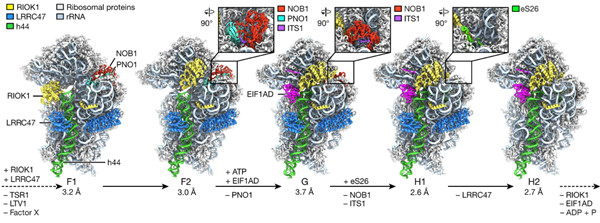
Fig 3 |Structures of human pre-40S ribosomal intermediates during final processing steps.
研究人员报道了人类40S亚基前体的五个冷冻电镜结构,它们描述了40S组装最终步骤中的组成和构象进展。这些结构解释了RIOK1在PNO1的置换和解离中的核心作用,这反过来又使核酸内切酶NOB1发生构象变化和激活。此外,研究人员观察到两个因子,即包含真核翻译起始因子1A结构域蛋白(EIF1AD)和富含亮氨酸的重复序列包含蛋白47(LRRC47),它们与RIOK1和中央rRNA螺旋44附近的40S前晚期颗粒结合。最后,功能数据表明EIF1AD为装配因子回收和18S-E加工所必需。
因此,这些结果能够详细了解人类细胞中40S形成的最后步骤,此外,还为人类与模式生物酿酒酵母之间小核糖体亚基形成的主要差异提供了证据。
(评论:最终的成熟事件都尚未解决,包括决定性rRNA切割步骤中NOB1的激活以及驱动最后生物发生因子解离的机制。)
文章来源:
Michael Ameismeier, Ivo Zemp et al, Structural basis for the final steps of human 40S ribosome maturation. DOI: 10.1038/s41586-020-2929-x. Nature:最新IF:43.07