活性氧(ROS)属于氧代谢的天然副产物,在正常情况下,机体内含量较低。然而,当机体受到损伤刺激时,比如药物毒性或缺氧,ROS水平会急剧增加。一旦超过了机体自身的清除能力,氧化-抗氧化平衡失调,细胞膜受损,最终导致细胞死亡。因此,测定ROS水平有助于评估细胞损伤程度。
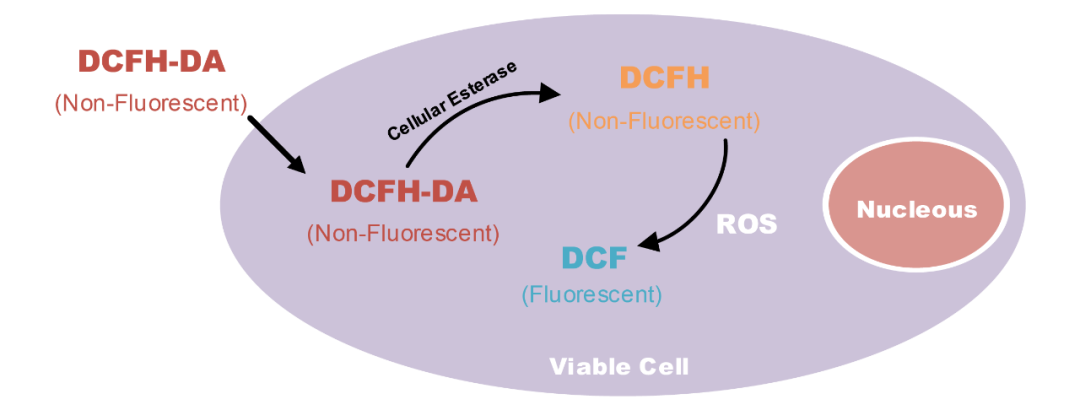
在目前的基本原理中,常用的细胞内ROS水平检测方法是DCFH-DA荧光探针法。DCFH-DA能够自由穿过细胞膜,在未被氧化时没有荧光。细胞内的酯酶可将DCFH-DA水解成不能穿过细胞膜的DCFH,从而在细胞内形成积聚。经过ROS氧化作用后,DCFH会转变成有荧光的DCF,其荧光强度与ROS水平成正比。
一、实验流程
以下是流式细胞仪检测贴壁细胞ROS的实验步骤及注意事项。
实验步骤:
1、准备细胞:将目的细胞均匀铺至六孔板中,实验组和对照组分别做相应处理,并预设空白管(即不装载探针)。至细胞密度达到80%-95%。
2、清洗:用PBS将六孔板中细胞分别清洗1-2次,并弃去PBS。
3、消化:用胰酶将六孔板中细胞消下来,移至1.5mlEP管中,并做好标记。
4、离心:1200r,常温,离心5min。
5、探针配制:按照2μl DCFH-DA原液:3ml无血清培养基配制,上下颠倒混匀(注意避光)。
6、加入探针:弃去4中培养基,空白管加入1ml无血清培养基,其余均加入1ml配制好的探针液,并重悬细胞(注意避光)。
7、孵育:37°C避光孵育20min。
8、离心:1200r,常温,离心5min,弃去上清。
9、清洗:用1ml冷PBS清洗,1200r,常温,离心5min,弃去上清,重复2次(注意避光)。
10、上机:将细胞用500μl冷PBS重悬,并移至流式管,上机。
注意事项:
1、消化细胞时,以细胞刚好掉落为好,不可时间过长,避免过度消化造成细胞损伤而影响实验结果。
2、探针配置时,一般按照1:1000用无血清培养基稀释DCFH-DA(终浓度为10Μm),不同的细胞系条件有所不同,需自行摸索。
3、加入探针后,一定要充分混悬细胞,以保证探针完全结合。
4、探针孵育时,每隔3-5min需颠倒混匀。
5、探针孵育时间不同细胞可能会不一样,一般为20-30min。
6、最佳激发波长为488nm,最佳发射波长为525nm。
二、结果分析
FlowJo 是一款流式细胞数据分析软件,通过图像分析细胞的各种变化,利用自带的分析功能,导出可以二次编辑的图形。它可以支持多种格式,并且可以做出质量不错的图。接下来介绍如何对活性氧(ROS)的流式-单染数据分析。
1、导入流式数据(以fcs格式为例):
将要导入的文件(一个或多个)拖入All Samples中。
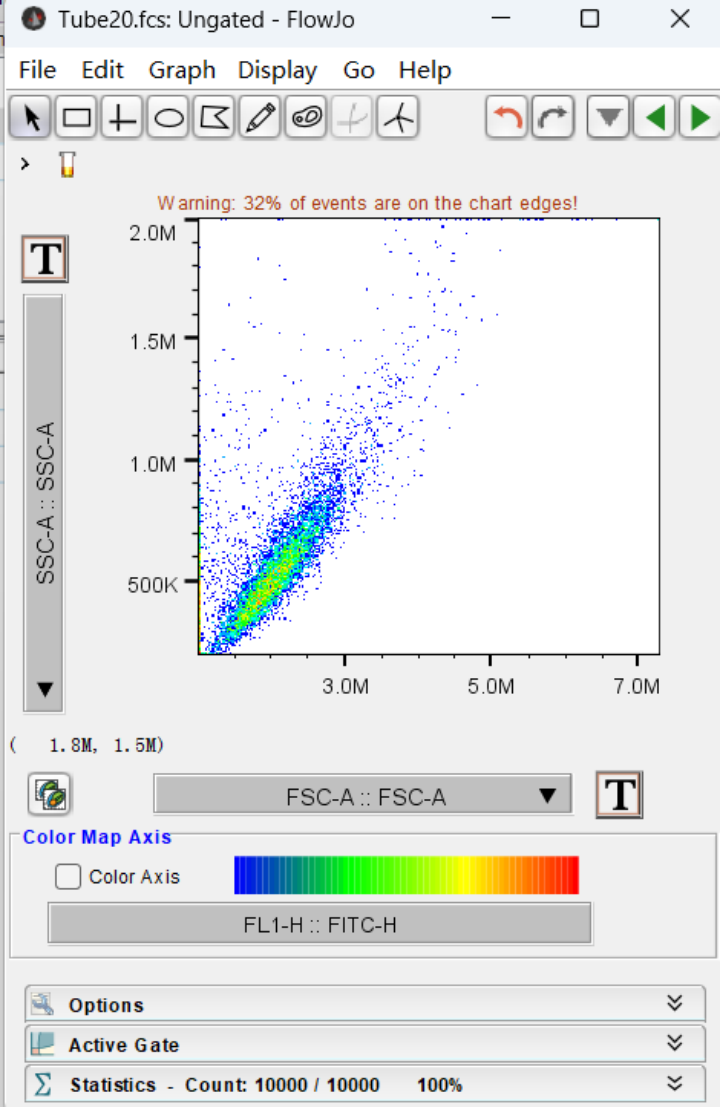
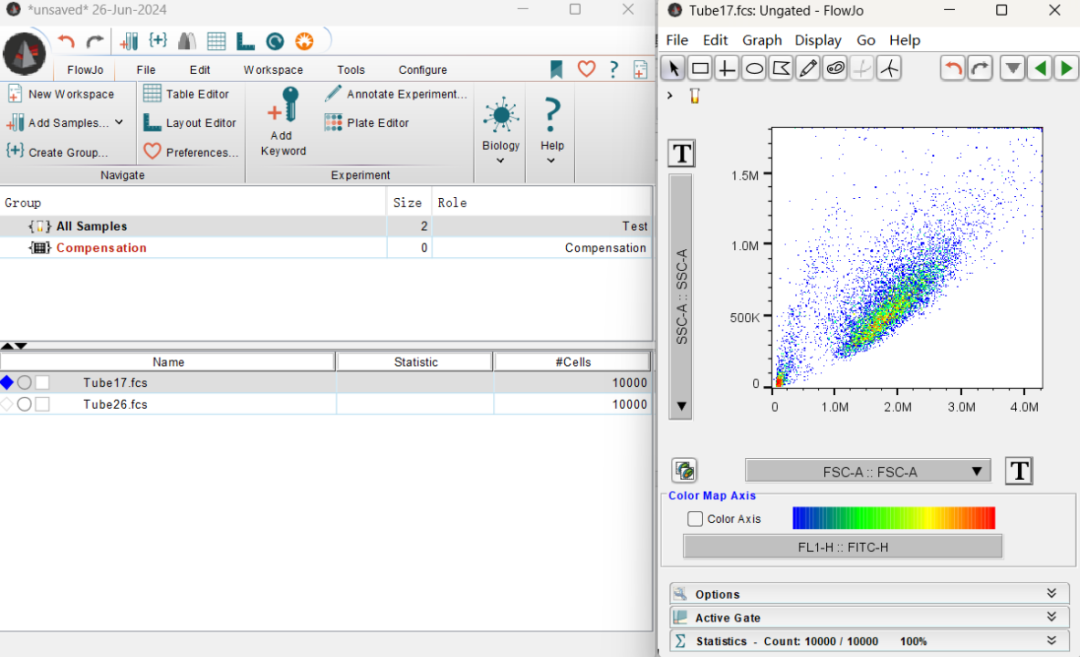
2、设置横纵坐标:
根据以下箭头所示位置,将横轴设置为FSC-A::FSC-A,纵轴设为SSC-A::SSC-A。
3、调整细胞群:
分别调整以下箭头所示位置,将绝大部分目的细胞调整至视野中。
选择Customize Axis,将细胞群调整至中间位置,点击Apply,横纵轴操作一样。
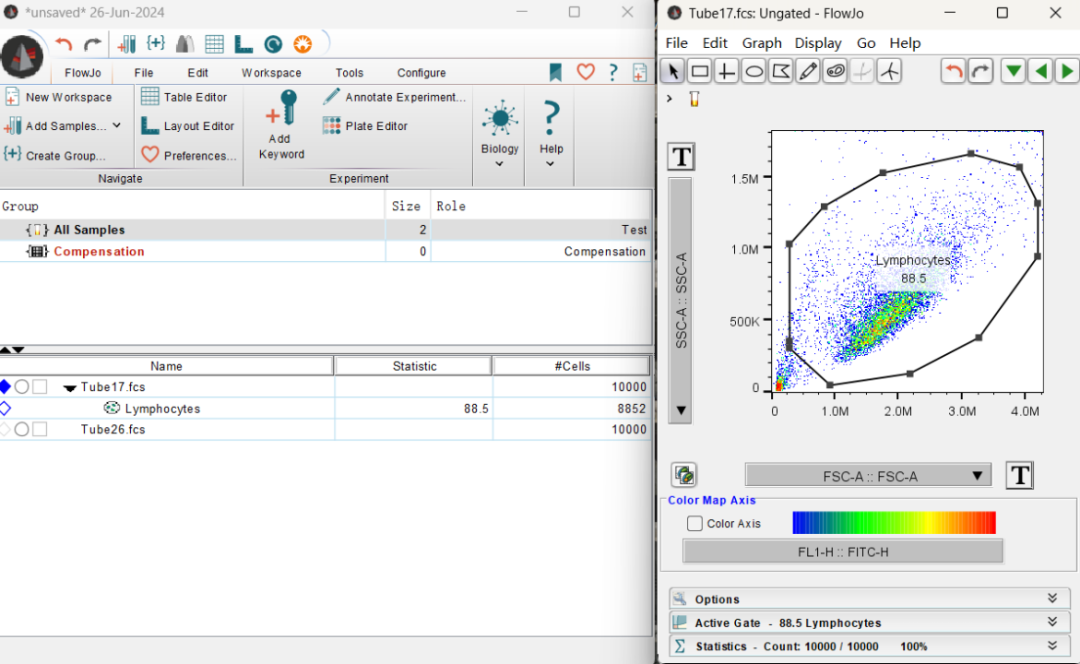
4、圈出主要细胞群:
点击下图所示位置,点击设门工具,选取目标细胞。
圈出大多数细胞至90%以上。弹出对话框输入细胞名称,点击OK。
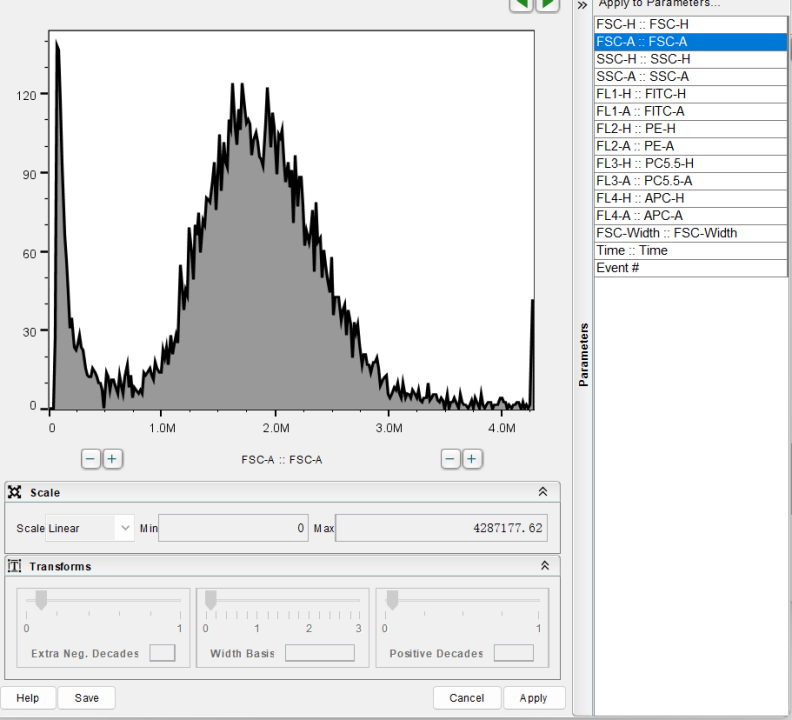
5、调整横纵坐标:
双击圈出的细胞群,就可以直观看到所圈出的细胞群。
参考步骤2将横轴改为FL4-A::APC-A,纵轴更换为Histogram,即X轴选择荧光通道,Y轴选择直方图。
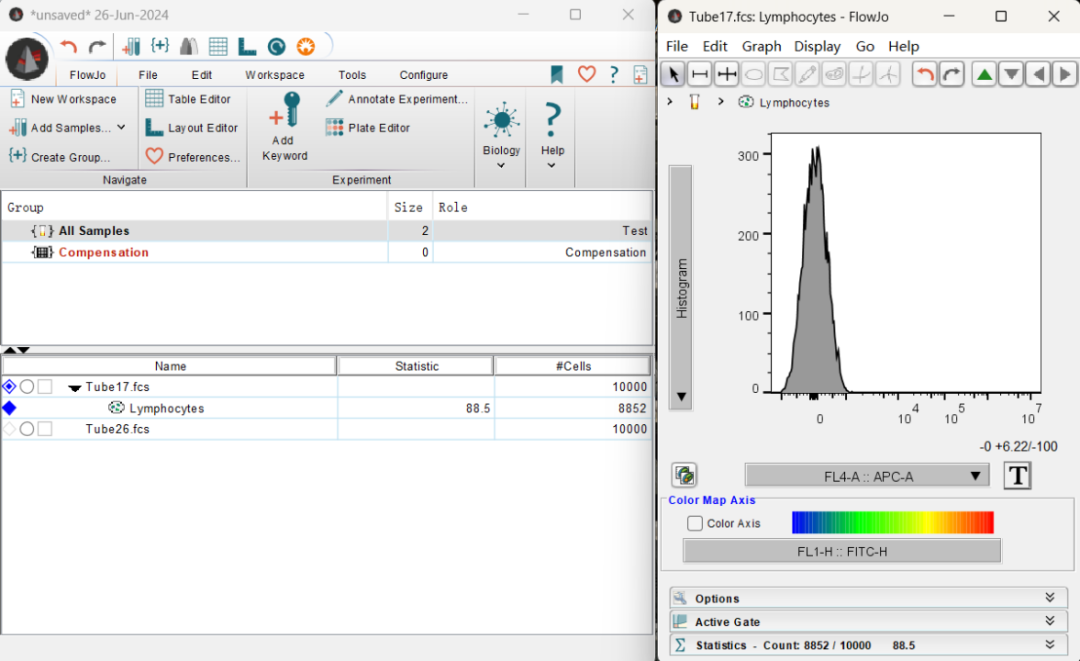
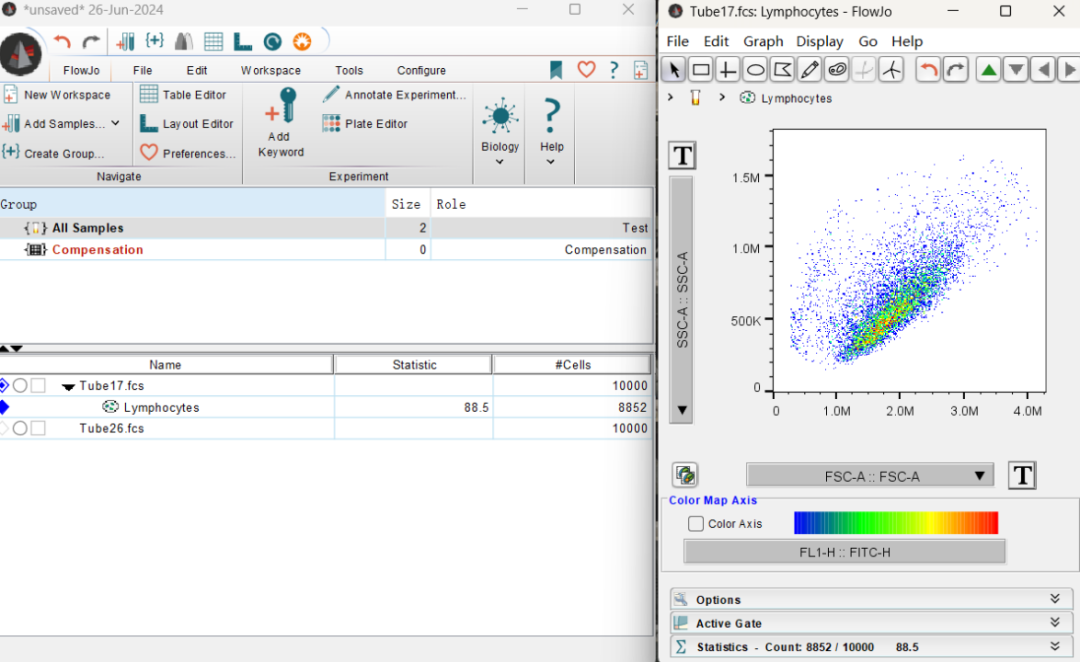
6、将门应用到所有细胞:拖动图8所示的门至上方的All Samples中,即可看到这个门应用到了所有细胞,(如果需要单独应用,则拖到相应的细胞即可。)双击任意一个门,即可看到刚才的直方图。点击上方的左右箭头可以查看其他的样本。

7、绘制图形
点击上方的Layout Editor,出现右侧涂层框。
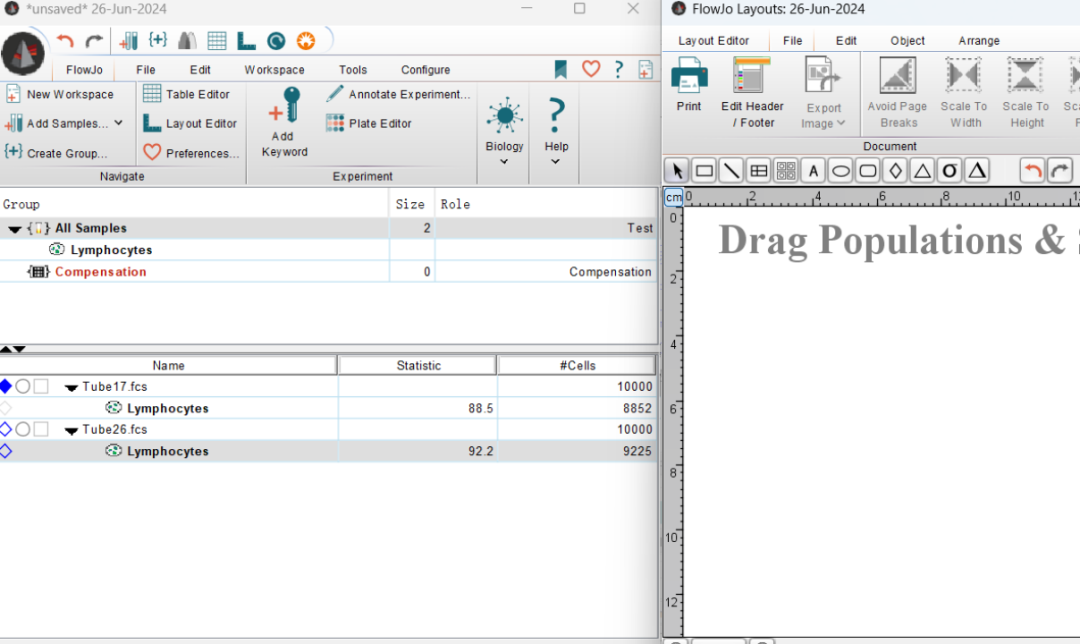
将一个门拖入涂层窗口中,这样会自动做一张信息图。
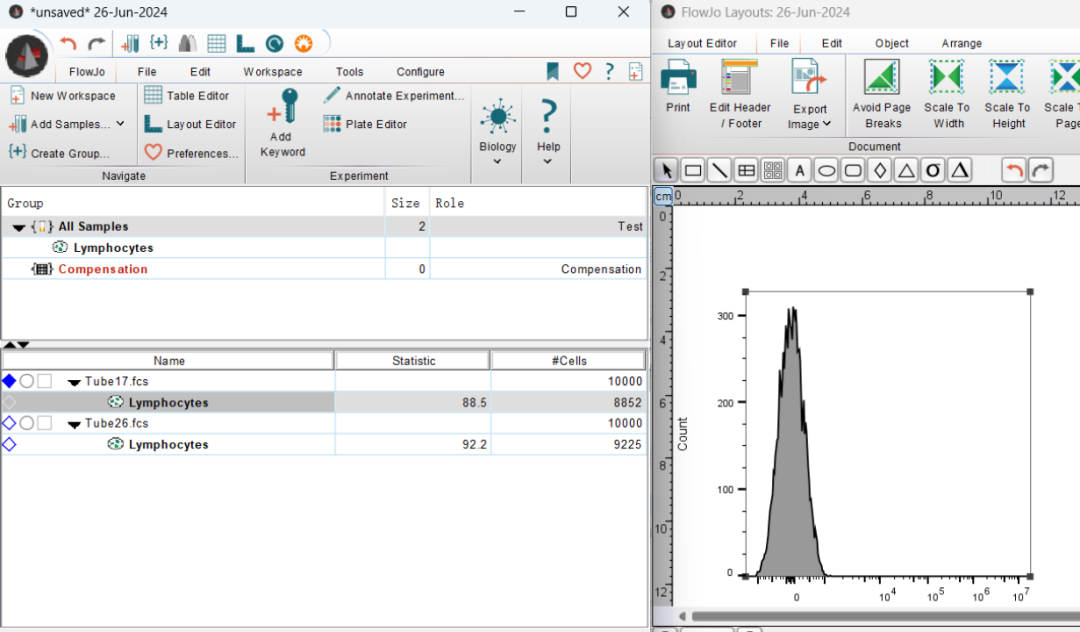
将其他的样本依次拖入这个直方图中(如果拖动到页面中就再单独添加一张图),就得到一张叠加图。
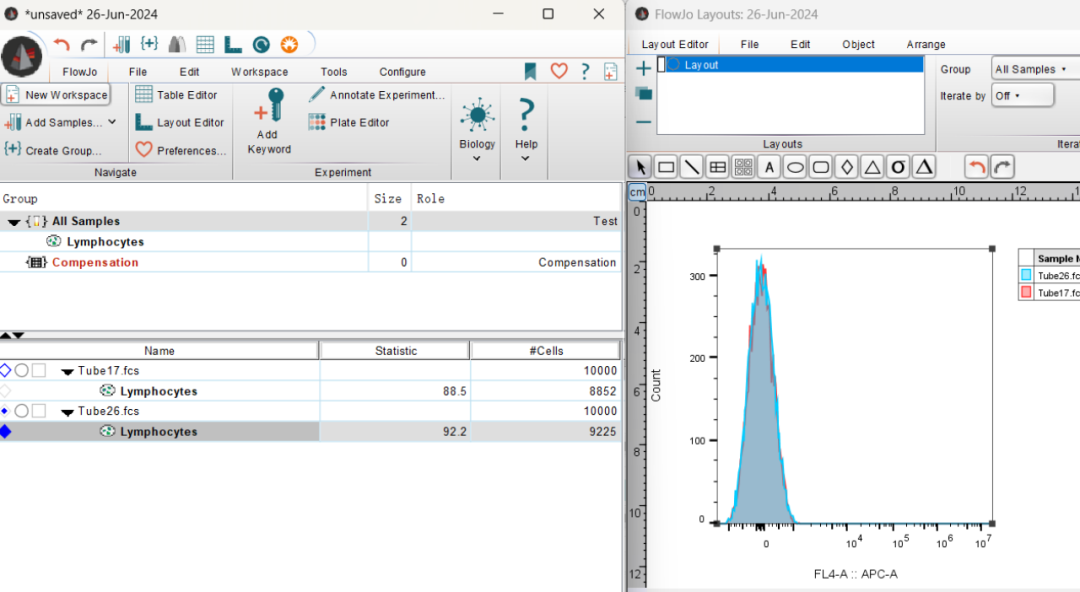
点击鼠标右键,在Histograms中可以选择直方图的叠加方式,比较常见的为Offset。
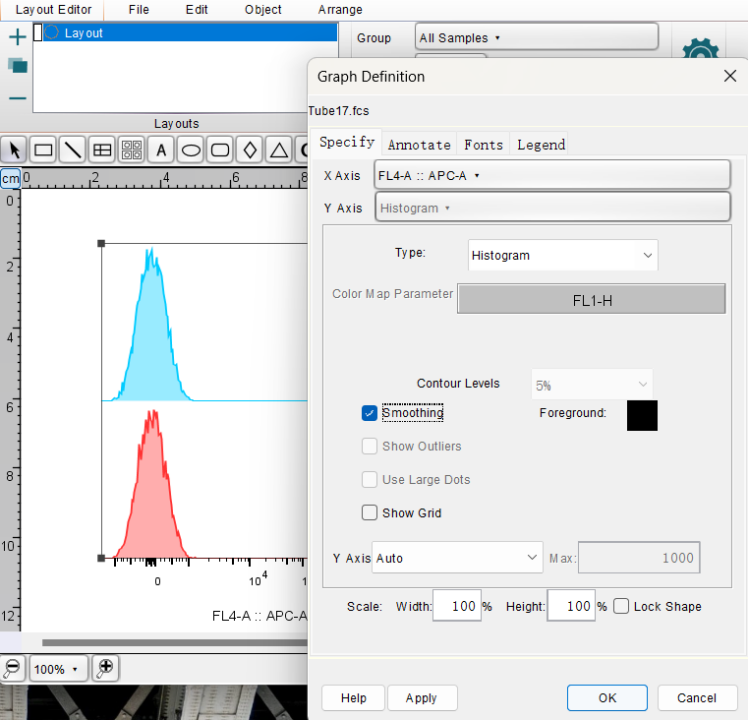
双击流式图,在Specity窗口中点击Smoothing对曲线进行平滑,会好看很多。

通常我们不需要右侧的表格,选中按下Delete进行删除,至此就得到了一张基本可以发表的流式图。
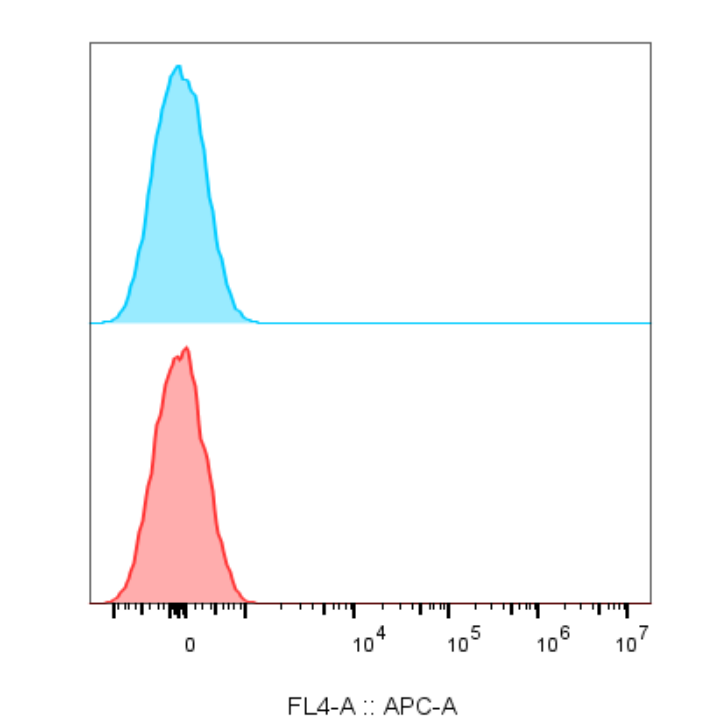
8、导出编辑:
在Layout的File菜单中,点击Export Image。如果使用AI,选择SVG格式;如果使用CorelDraw,使用EMF格式。








