1、Nature:绘制SV参考图谱
2020年5月27日,来自美国麻省理工学院和哈佛大学广泛研究所Michael E. Talkowski研究团队在《自然》杂志上发表了题为“A structural variation reference for medical and population genetics”的研究结果,构建了医学和群体遗传学的结构变异(SV)参考。
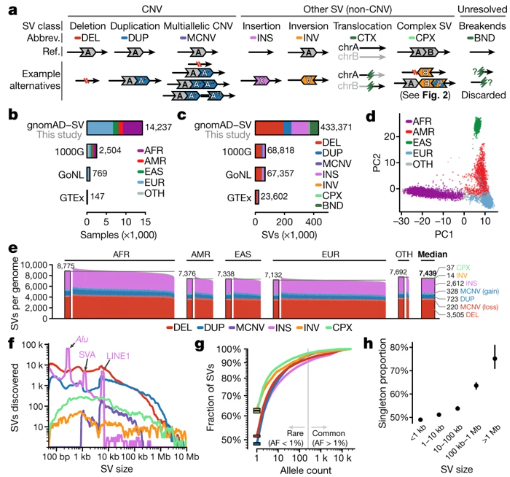
Fig. 1: Properties of SVs across human populations.
介绍了基因组聚合数据库(gnomAD)中由全球不同群体(54%非欧洲人)的14,891个基因组构建的序列解析SV的参考。他们发现了433,371个SV的丰富而复杂图谱,据此他们估计SV占每个基因组所有罕见蛋白质截短事件的25-29%。他们发现自然选择与破坏性单核苷酸变异(SNV)和破坏或复制蛋白质编码序列的稀有SV之间有很强的相关性,这表明对功能丧失高度不耐受的基因也对剂量增加敏感。
还发现了顺式调控元件中针对非编码SV的适度选择,尽管针对蛋白质截短SV的选择比所有非编码效果都强。最后,他们在3.9%的样本中发现了非常大(超过1兆碱基)的稀有SV,并估计有0.13%的携带SV的个体符合临床上重要的偶然发现的现有标准。该SV资源可通过gnomAD浏览器自由分配,并将在群体遗传学、疾病关联研究和诊断筛查中具有广泛的用途。
据了解,SV重新排列了DNA的大片段,可能对进化和人类疾病产生深远的影响。随着国家生物银行、疾病关联研究和临床基因测试越来越依赖于基因组测序,诸如gnomAD之类的群体参考资料已成为SNV注释的组成部分。但是,尚无与SNV相比可比的高覆盖度基因组测序的SV参考图谱。
(评论:最大规模的基因组测序,为研究基因功能奠定了基础)
来源:
Ryan L. Collins, Harrison Brand et al, A structural variation reference for medical and population genetics. DOI: 10.1038/s41586-020-2287-8. Nature:最新IF:43.07
2、Science:科学家开发新冠病毒DNA疫苗
2020年5月20日,来自美国哈佛大学Dan H. Barouch研究组在《科学》上发表了题为“DNA vaccine protection against SARS-CoV-2 in rhesus macaques .”的研究结果,开发新冠病毒(SARS-CoV-2)DNA疫苗,可保护恒河猴抵御感染。
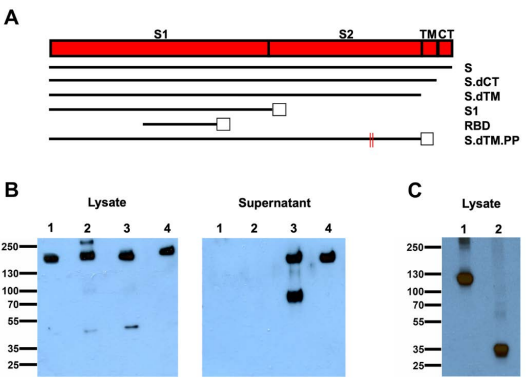
Fig. 2. Construction of candidate DNA vaccines against SARS-CoV-2.
研究人员开发了一系列表达不同形式SARS-CoV-2突刺(S)蛋白的DNA候选疫苗,并在35只恒河猴中对其进行了评估。接种疫苗的动物产生了体液和细胞免疫反应,包括效价与在恢复期的人和感染SARS-CoV-2的恒河猴中发现的效价相当的中和抗体。
接种疫苗后,所有动物均接受了SARS-CoV-2感染,与对照组相比,编码全长S蛋白的疫苗分别使支气管肺泡灌洗液和鼻黏膜中值病毒载量减少了超过3.1 log10和3.7 log10。疫苗引起的中和抗体滴度与保护功效相关,表明保护与免疫相关。
这些数据证明了在非人类灵长类动物中SARS-CoV-2疫苗的保护作用。
(评论:开发新冠病毒疫苗是可能的)
文章来源:
Jingyou Yu, Lisa H. Tostanoski et al, DNA vaccine protection against SARS-CoV-2 in rhesus macaques. DOI: 10.1126/science.abc6284. Science:最新IF:41.037
3、Science:病毒逃逸CRISPR-Cas免疫机制
2020年5月28日,来自美国洛克菲勒大学Luciano A. Marraffini和美国纪念斯隆·凯特琳癌症中心Dinshaw J. Patel研究团队合作在《科学》杂志上发表了题为“A phage-encoded anti-CRISPR enables complete evasion of type VI-A CRISPR-Cas immunity.“的研究结果,提出噬菌体编码的抗CRISPR可完全逃逸VI-A型CRISPR-Cas免疫。
描述了一种编码抗CRISPR蛋白(AcrVIA1)的李斯特菌噬菌(?LS46),该蛋白可以灭活李斯特菌的VI-A CRISPR系统。 利用遗传学、生物化学和结构生物学方法,发现AcrVIA1与Cas13a的引导接触表面相互作用,从而阻止了靠近靶RNA以及核酸酶激活所需的构象变化。
不同于DNA切割Cas核酸酶的抑制剂,其会导致有限的免疫抑制并需要多次感染才能绕过CRISPR防御,单个病毒体递送的单剂量AcrVIA1可以完全消除VI-A CRISPR介导的免疫力。
据了解,crRNA引导的核酸酶Cas13识别互补的病毒转录本,以在VI型CRISPR-Cas抗病毒反应期间触发宿主和病毒RNA的降解。病毒如何抵消这种免疫力尚不清楚。
(评论:学习了)
文章来源:
Alexander J. Meeske, Ning Jia et al , A phage-encoded anti-CRISPR enables complete evasion of type VI-A CRISPR-Cas immunity .DOI: 10.1126/science.abb6151,Science:最新IF:41.037