1、Nat Med: 血液和肿瘤中IL-8水平与PD-L1抑制剂临床效益有关
近日来自美国基因泰克公司Sanjeev Mariathasan、Mahrukh A. Huseni等研究人员在Nature Medicine杂志上发表了题为"High systemic and tumor-associated IL-8 correlates with reduced clinical benefit of PD-L1 blockade"的研究论文,分析了接受PD-L1单抗atezolizumab(阿特珠单抗,Tecentriq)治疗的1445名转移性尿路上皮癌(mUC)和转移性肾细胞癌患者的外周血单核细胞和肿瘤中循环的pIL-8和IL8基因的表达。
尽管血浆白细胞介素8(pIL-8)升高与免疫检查点阻断的不良预后相关,但尚未在大型随机研究中进行全面评估。
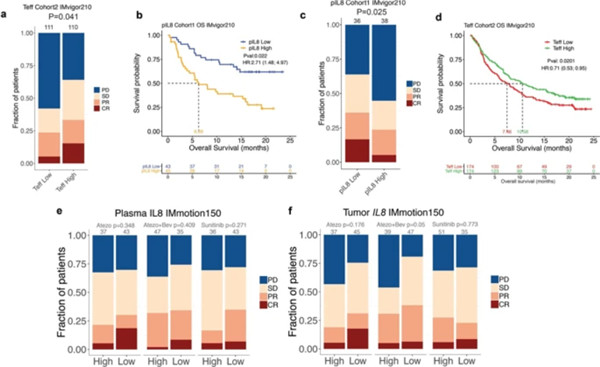
Fig.1 , pIL8基线与较差的临床结果相关(来源:Nat Med)
研究人员在1,445例转移性尿路上皮癌(mUC)和转移性肾细胞癌患者的多个随机试验中,分析了atezolizumab(抗PD-L1单克隆抗体)治疗的患者外周血单核细胞和肿瘤中循环pIL-8和IL8基因的表达。血浆、外周血单核细胞和肿瘤中高水平的IL-8与atezolizumab在mUC和转移性肾细胞癌患者中的疗效降低相关,即使在经典CD8+T细胞炎症的肿瘤中也是如此。
mUC患者的低基线pIL-8与atezolizumab和化疗的反应增加有关。接受atezolizumab治疗但未接受化疗的mUC患者在治疗中pIL-8降低,总体生存率提高。免疫区室的单细胞RNA测序显示IL8主要在循环和肿瘤内的髓样细胞中表达,而IL8的高表达与抗原呈递机器的下调有关。逆转IL-8介导髓样炎症的疗法对于改善接受免疫检查点抑制剂治疗的患者结局至关重要。
(评论:重大发现,学习了)
文章来源:
Yuen, K.C., Liu, L., Gupta, V. et al. High systemic and tumor-associated IL-8 correlates with reduced clinical benefit of PD-L1 blockade. Nat Med 26, 693-698 (2020). https://doi.org/10.1038/s41591-020-0860-1
2、Nat Med:新单细胞工具可用于新鲜和冷冻人类肿瘤分析
2020年5月11日,美国麻省理工学院Aviv Regev、Orit Rozenblatt-Rosen等研究人员在发《自然—医学》上表了题为“A single-cell and single-nucleus RNA-Seq toolbox for fresh and frozen human tumors”的研究结果,合作开发了新单细胞工具可用于新鲜和冷冻人类肿瘤的分析。
研究人员开发了系统型工具,即分别使用单细胞RNA-Seq(scRNA-Seq)和单核RNA-Seq(snRNA-Seq)对新鲜和冷冻的临床肿瘤样品进行分析。研究人员分析了23个标本中40个样品的216,490个细胞和细胞核,这些标本涵盖了八种不同组织和样品特征的肿瘤类型。
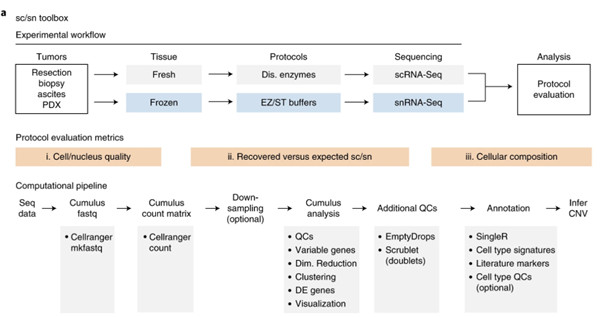
Fig. 3: Study and toolbox overview.(来源:Nat Med)
研究人员通过细胞和细胞核质量、恢复率和细胞组成评估了方案。匹配样品中的scRNA-Seq和snRNA-Seq可得到相同的细胞类型,但比例不同。
这一工作为广泛的肿瘤研究提供了指导,包括从其他肿瘤工具中测试和选择方法的标准,从而为绘制肿瘤图谱铺平了道路。
据了解,单细胞基因组学对于绘制肿瘤生态系统至关重要。尽管单细胞RNA-Seq(scRNA-Seq)可以分析从新鲜肿瘤中分离的细胞中的RNA,但仍需要单核RNA-Seq(snRNA-Seq)来分析冷冻或难分离的肿瘤。每一种都需要针对不同的组织和肿瘤类型进行定制,这为采用提供了障碍。
(评论:学习了)
文章来源:Michal Slyper, Caroline B. M. Porter, A single-cell and single-nucleus RNA-Seq toolbox for fresh and frozen human tumors,DOI: 10.1038/s41591-020-0844-1,Nature Medicine:最新IF:30.641
3、Cell Stem Cell:CRISPR-Cas9汇集筛选鉴定出人结肠类器官中的肿瘤抑制因子
近日来自德国癌症研究中心(DKFZ)Henner F. Farin研究组在《细胞—干细胞》上发表了标题为“Pooled In Vitro and In Vivo CRISPR-Cas9 Screening Identifies Tumor Suppressors in Human Colon Organoids”的研究结果,利用体内外CRISPR-Cas9汇集筛选,鉴定出人结肠类器官中的肿瘤抑制因子。
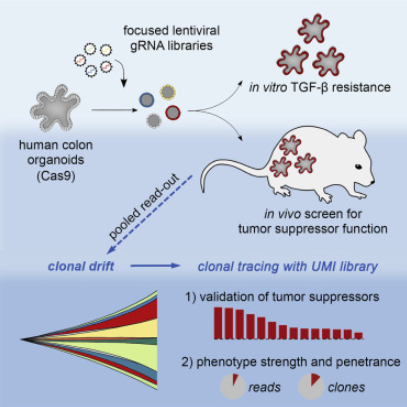
Fig 3 | (来源:Cell Stem Cell)
为促进高通量遗传测试和肿瘤驱动程序的功能鉴定,研究人员开发了一个平台,可用于在人类结肠类器官中进行CRISPR-Cas9汇集筛选。使用转化生长因子β(TGF-β)抗性作为建立体外敏感性和可扩展性的范例,研究人员确定了在3D类器官中筛选的最佳条件和严格的向导RNA(gRNA)要求。
然后,研究人员使用APC-/-在恶性前类器官中筛选了全癌肿瘤抑制基因(TSG)库; KRAS G12D突变被异种移植以研究复杂肿瘤微环境中的克隆优势。研究人员确定TGFBR2是最普遍的TSG,其次是已知和未知的结直肠癌(CRC)生长介导因子。
在二级筛选中使用唯一的分子标识符(UMI)对gRNA进行了验证,从而可以调整克隆的漂移并区分克隆的大小和丰度。
(评论:这些发现突出了一个强大的基于类器官的平台,可用于针对患者特定功能基因组学的汇集CRISPR-Cas9筛选。)
文章来源:Birgitta E. Michels et al, Pooled In Vitro and In Vivo CRISPR-Cas9 Screening Identifies Tumor Suppressors in Human Colon Organoids,DOI: 10.1016/j.stem.2020.04.003,Cell Stem Cell:最新IF:21.464