1、Nature Biotechnology:新型无线无电池完全植入式可溶解心脏起搏器
2021年6月28日,来自美国西北大学John A. Rogers团队在《自然-生物技术》发表了题为“Fully implantable and bioresorbable cardiac pacemakers without leads or batteries.”的研究结果,研究出新型无线无电池完全植入式可溶解心脏起搏器。
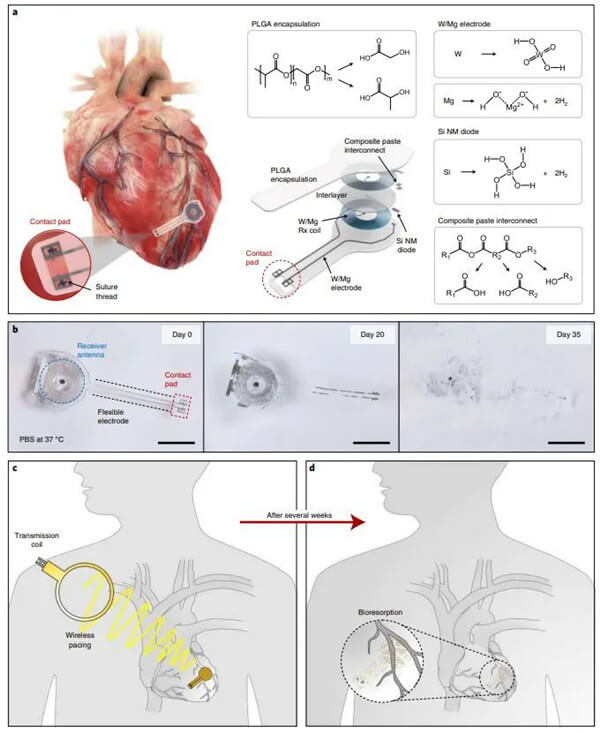
研究人员研发了一种无引线、无电池、完全植入式心脏起搏器,用于术后控制心率和节律,并且在限定的操作时间内可通过自然生物过程完全溶解和清除。研究人员展示了这些设备在小鼠、大鼠、兔、犬和人类心脏模型中可为各种大小的心脏提供有效起搏,并具有特定的几何形状和操作时间尺度,其由无线能量传输提供能量支持。这种方法克服了传统临时起搏装置的主要缺点,可作为下一代术后临时起搏技术的基础。
据了解,在手术恢复期间使用的临时心脏起搏器需要跨皮肤的导线和外部硬件,这些硬件具有感染风险、限制患者活动并可能在移除导线期时损坏心脏功能。
(评论:如果能实现在人类上简直一大福音,避免传统起搏器带来的风险同时也是健康安全高效的治疗手段。)
文章来源:
Yeon Sik Choi, Rose T. Yin et al, Fully implantable and bioresorbable cardiac pacemakers without leads or batteries, DOI: 10.1038/s41587-021-00948-x,最新IF:31.864
2、Science:植物生殖细胞特异DNA甲基化重编程的分子机制
2021年7月2日,来自英国约翰因斯中心冯小琦课题组在《科学》发表了题为“Nurse cell-–derived small RNAs define paternal epigenetic inheritance in Arabidopsis.”的研究论文,揭示看护细胞来源的小 RNA 定义了拟南芥中的父本表观遗传。
植物雄性种系经历 DNA 甲基化重编程,并从头甲基化基因,从而改变基因表达并调节减数分裂。他们揭示了这种重编程背后的分子机制。
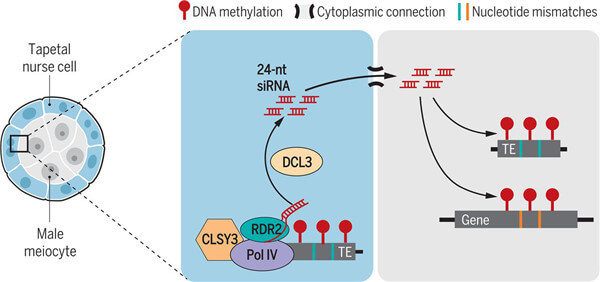
他们证明从精母细胞到精子的雄性生殖系中的基因甲基化是由 24 个核苷酸的小干扰 RNA (siRNA) 建立的,这些小干扰 RNA (siRNA) 从具有不完美序列同源性的转座子转录而来。 这些 siRNA 由精母细胞看护细胞 (绒毡层) 通过 CLSY3 的活性合成,CLSY3 是其他花药细胞中不存在的染色质重塑子。绒毡层siRNA 控制整个基因组中的种系甲基化,包括精子中的遗传甲基化模式。绒毡层来源的 siRNA 还可以沉默种系转座子,从而保护基因组的完整性。他们的结果表明,绒毡层siRNA 足以重建种系甲基化模式,并在整个雄性种系中驱动功能性甲基化重编程。
(评论:不仅诠释了RdDM通过特别招募Pol IV 及sRNA碱基错配形成细胞特异的甲基化模式的分子机制,而且翻开了被子植物跨代表观遗传机制的新篇章。)
文章来源:
Jincheng Long, James Walker et al,Nurse cell-–derived small RNAs define paternal epigenetic inheritance in Arabidopsis. DOI: 10.1126/science.abh0556, Science:最新IF:41.037
3、Nature Genetics::人类大脑、肺、心脏和肌肉中m6A甲基化的遗传驱动因素
2021年7月1日,来自美国麻省理工学院Manolis Kellis研究团队在《自然—遗传学》杂志上发表了题为“Genetic drivers of m6A methylation in human brain, lung, heart and muscle.”的研究论文,揭示人类大脑、肺、心脏和肌肉中m6A甲基化的遗传驱动因素。
据悉,最普遍的转录后mRNA修饰m6A具有多种RNA调节作用,但其在人体组织中的遗传控制仍然未知。
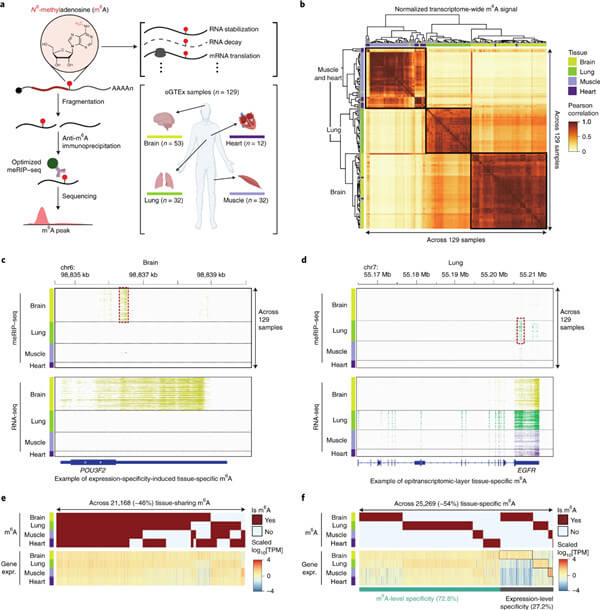
研究人员报告了129个转录组范围的N6-甲基腺苷(m6A)测序,涵盖来自GTEx/eGTEx的91名个体和4个组织(脑、肺、肌肉和心脏)。研究人员将这些与个体间遗传和表达变异相结合,揭示了8,843个组织特异性和469个组织共享的m6A数量性状基因座(QTL)。研究人员将m6A QTL与疾病遗传学相结合,鉴定了184个GWAS 共定位的m6A QTL,包括潜在的神经质、抑郁、精神分裂症和焦虑症的脑部m6A QTL;肺m6A QTL是呼气流量和哮喘的基础;肌肉/心脏m6A QTL是冠状动脉疾病的基础。
最后,研究人员预测了新的m6A调节因子,这些调节因子在m6A QTL中显示出优先结合、与已知m6A调节因子的蛋白质相互作用,并与其靶标的m6A水平的表达相关性。这些研究结果为理解表观转录组修饰的顺式和反式调节、它们的个体间变异及其在人类疾病中的作用提供了重要的见解和资源。
(评论:发现了超过 278,000 个 m6A 修饰位点,极大地扩展了已知的 m6A 数量;可作为新的表观转录组分子表型,解释 GWAS 发现的变异位点的调控机制;)
文章来源:
Genetic drivers of m6A methylation in human brain, lung, heart and muscle. DOI: 10.1038/s41588-021-00890-3, Nature Genetics:最新IF:25.455