1、Nature:新型“滴血验癌”技术利用DNA片段检测多种肿瘤
近日,来自约翰˙霍普金斯大学Kimmel癌症中心的研究人员在Nature上发表了题为“Genome-wide cell-free DNA fragmentation in patients with cancer “的研究论文,研究人员开发了一种简单的新型血液检测方法,通过检测癌细胞脱落的DNA碎片可以检测出7种不同类型癌症。
研究人员采取了一种名为“DELFI”的方法,通过查看血液中来自基因组不同区域DNA的大小和数量来研究DNA被包装在细胞核内的方式,进而寻找肿瘤细胞与正常细胞的差异性。
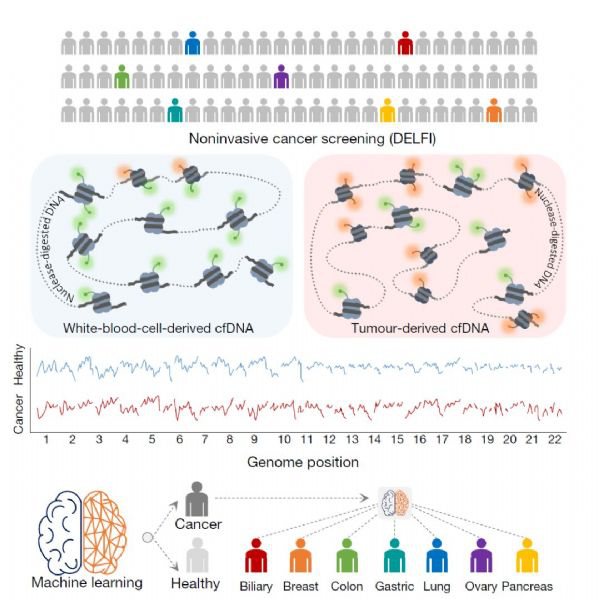
(图1 来源Nature DELFI工作示意图)
对来自208名癌症患者的cfDNA进行低覆盖率的全基因组测序,其中包括54名乳腺癌患者、27名结肠直肠癌患者、12名肺癌患者、28名卵巢癌患者、34名胰腺癌患者、27名胃癌患者和26名胆管癌患者。他们还进行了全基因组测序,以分析215名健康个体的cfDNA。总体而言,健康个体具有相似的碎片特征,而患有癌症的患者具有更多可变的碎片特征,与健康个体的特征具有明显差异。
DELFI在73%的癌症患者中检测到癌症,而对215个健康个体的检测中的产生了4个错误分析(特异性为98%)。同时,研究人员,还发现该测试在鉴定cfDNA起源组织方面准确率为61%-75%。当DELFI和突变的cfDNA分析相结合时,研究人员可以准确地检测出91%的癌症患者。
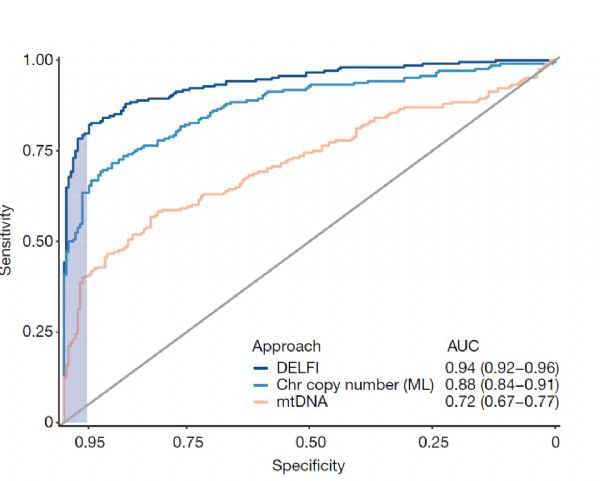
(图2 来源Nature:DELFI分析的准确性分析)
由于该测试易于管理并采用简单且廉价的实验室方法,因此预计该测试最终可能比其他癌症筛查测试(包括其他当前的cfDNA测试)更具成本效益,也就更适用于临床使用。
(评论:滴血验癌一直是研究的重难点,若真能实现对患者的预防治疗会有很大的帮助。)
文章来源:
Robert B. Scharpf, Victor E. Velculescu. Genome-wide cell-free DNA fragmentation in patients with cancer. Nature. 29 May 2019
今日,来自芝加哥大学的研究人员在Nature上发表了题为“Proteomics reveals NNMT as a master metabolic regulator of cancer-associated fibroblasts “的研究文章,研究人员通过将新开发的激光捕获显微切割技术与高灵敏蛋白质组分析技术相结合,发现了调控HGSC转移的关键蛋白——NNMT,同时指出抑制NNMT活性可以有效抑制HGSC的转移,为治疗HGSC提供了极佳的靶点!
NNMT是什么?NNMT是一种S-腺苷-L蛋氨酸(SAM)依赖性胞质酶,可催化SAM生成S-腺苷同型半胱氨酸(SAH),在多种药物和异型生物质的生物转化和解毒中起重要作用。而SAM是细胞内包括组蛋白在内的多种物质的主要甲基化供体,也就是说,NNMT可以通过影响组蛋白的甲基化来调控基因表达,这也是NNMT对HGSC转移的真正作用机制。
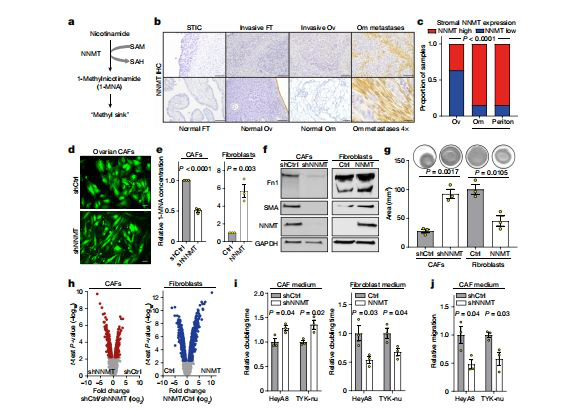
(图3 来源Nature:NNMT在HGSC转移的基质中上调,进而调节CAF表型)
研究人员发现,NNMT敲低后,CAFs细胞中SAM:SAH的比例明显上调,同时DNA的甲基化水平随之升高,而与转录调控相关的组蛋白的甲基化修饰也显着增加。他们指出,NNMT正是通过这种机制调控了上千种基因的表达,而许多HGSC相关的重要促癌因子也包含其中,由此促进了HGSC的转移。换言之,CAFs正是在NNMT的调控下兴风作浪,才最大限度地促进了HGSC转移。
蛋白质是调控多种机能的重要单位,因此,想要破解CAFs作用难题,就得找出CAFs作用中最为核心的功能蛋白。研究人员利用激光捕获显微切割技术,从11位HGSC病人中采集了107个样本并进行了高灵敏蛋白质组分析。结果显示NNMT在网膜转移的肿瘤基质中高表达,与原发肿瘤基质中的表达量有明显差异。只要将CAFs细胞中的NNMT敲低,就可以让CAFs相应的标志物表达量降低,同时使细胞趋于正常形态
(评论:这项研究为HGSC的治疗提供了一个绝佳的新靶点,并证实了该靶点的干预有利于HGSC的治疗,有望以全新的切入点遏制肿瘤的转移,为HGSC患者求得一线生机。)
文章来源:
Mark A. Eckert,et al. Proteomics reveals NNMT as a master metabolic regulator of cancer-associated fibroblasts.Nature (2019) .
近日,来自广西医科大学何松青团队在Cell Research 在线发表题为“Complement C3 activation regulates the production of tRNA-derived fragments Gly-tRFs and promotes alcohol-induced liver injury and steatosis”的研究论文,该研究探索了C3促成乙醇诱导的肝脏脂肪变性的潜在机制,并且评估了CR2-Crry在乙醇诱导的肝脏脂肪变性和小鼠炎症中的治疗效果。 此外,研究人员分析了Gly-tRF的作用及其与AFLD小鼠模型中补体激活的关系,并使用Gly-tRF反义抑制剂评估了潜在的治疗策略。研究结果表明,C3激活产物通过调节Gly-tRF的表达促成肝细胞增多症。 C3活化步骤的补体抑制和Gly-tRF抑制剂治疗可能是AFLD的潜在和精确的治疗方法。
研究人员探索了C3促成乙醇诱导的肝脏脂肪变性的潜在机制,并且评估了CR2-Crry在乙醇诱导的肝脏脂肪变性和小鼠炎症中的治疗效果。 此外,研究人员分析了Gly-tRF的作用及其与AFLD小鼠模型中补体激活的关系,并使用Gly-tRF反义抑制剂评估了潜在的治疗策略。
在这里,研究人员通过用C3激活的特异性抑制剂CR2-Crry治疗证明了对野生型小鼠的保护作用。甘氨酸转移(t)RNA衍生片段(Gly-tRFs)的表达在乙醇喂养的小鼠中上调,并且体内Gly-tRF的抑制减少慢性乙醇喂养诱导的肝脂肪变性而不影响炎症。 Gly-tRF的表达在C3缺陷或CR2-Crry处理的小鼠中下调,但在C5缺陷小鼠中不表达。
肝组织的转录组分析显示Gly-tRF抑制剂上调sirtuin1(Sirt1)的表达,并随后影响下游脂肪生成和β-氧化途径。在机制上,Gly-tRF与AGO3相互作用以通过3'UTR中的序列互补性下调Sirt1表达。值得注意的是,与健康对照相比,在AFLD患者中,C3d,CYP2E1和Gly-tRF的表达水平上调,而Sirt1降低。
(评论:总的来说,研究结果表明,C3激活产物通过调节Gly-tRF的表达促成肝细胞增多症。 C3活化步骤的补体抑制和Gly-tRF抑制剂治疗可能是AFLD的潜在和精确的治疗方法。)
文章来源:
Fudi Zhong, Zhigao Hu, Keqing Jiang, et al. Complement C3 activation regulates the production of tRNA-derived fragments Gly-tRFs and promotes alcohol-induced liver injury and steatosis. Cell Res. 10 May 2019