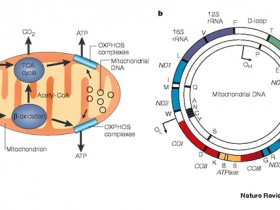
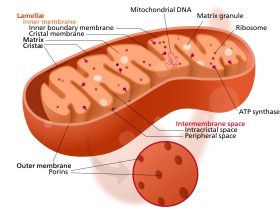
综述:线粒体作为细胞能量的“供应站”,半自主遗传细胞器,有着独立的遗传物质,即线粒体DNA(mtDNA)。mtDNA可能会携带致病突变并带来严重的结果。由此,基因编辑可能是一种有效的补救方法。近日,两篇最新研究发现,在治疗线粒体DNA突变上,被誉为具有潜在革命性医疗工具的基因编辑工具CRISPR未起到关键性作用。相比之下,传统基因编辑工具,包括:TALENs和ZFNs将纠正小鼠体内的线粒体DNA突变。
线粒体含有自己的DNA,但它们也可能携带致病突变
研究表明,锌指核酸酶(ZFNs)和转录激活子样效应核酸酶(TALENs)这两种传统的基因编辑工具可以大幅减少线粒体疾病小鼠体内有缺陷的mtDNA的数量,继而抵消这种突变的影响。这一原理验证结果或为线粒体疾病的首次治疗提供了重要依据。
线粒体DNA (mtDNA)致病突变导致的遗传病的概率很高,每5000个成年人中就有1个,疾病症状表现广泛,从肌肉无力到心脏病不等。领导其中一个研究小组的英国剑桥大学的分子生物科学家Michal Minczuk说:“如果将所有线粒体疾病结合起来,它们是人类遗传病最常见的原因之一。”
研究人员还没有发现任何针对有mtDNA遗传有缺陷患者的治疗方法。只要用基因编辑技术剪断突变的mtDNA,线粒体就会摧毁被切断的分子,使其失去遗传特性。此外,潜在治疗可能不需要消除体内无数线粒体中所有存在缺陷的mtDNA。领导另一个研究小组的佛罗里达迈阿密大学米勒医学院的线粒体生物学家Carlos Moraes指出,线粒体疾病患者的mtDNA拷贝中包含有害突变和无害突变,这两种突变之间的比例必须达到一定的水平才会出现疾病症状。因此,他提出观点:“如果能把这个比例降低到阈值以下,临床表现可能就会消失。”
CRISPR作为最新研究发展的基因编辑技术,在编辑细胞核DNA中发现的突变方面近年来取得了快速发展,但这项技术难以应用于mtDNA的编辑,因为线粒体不具备引导RNA的能力,无法让该工具按照正确的序列定位。
因此,这两个团队使用了另外两种传统编辑方法——锌指核酸酶(ZFNs)和转录激活器样效应核酸酶(TALENs)。虽然这些系统比CRISPR更麻烦且功能更少,但它们也可以识别特定位点使DNA断裂。
剑桥大学的ZFNs编辑系统
在剑桥大学的研究中,Minczuk和他的博士后Payam Gammage以及他的同事们利用无害的病毒载体,将DNA编辑蛋白的基因转移到突变小鼠的细胞中。在这种菌株中,一些mtDNA拷贝在一种转移RNA (tRNA)的基因编码中有突变,这种RNA有助于组装线粒体蛋白。按这样的思路,他们设计了ZFNs,并将携带病毒的载体注入小鼠的尾静脉。病毒载体一旦进入血液,就会进入心脏,而心脏也隐藏着有缺陷的mtDNA。65天后,当研究人员分析这些动物的心脏组织时,他们发现突变线粒体DNA的比例要低40%左右。
由于轻微的心脏异常很难被记录下来,研究人员使用分子指标来衡量治疗的成功程度。两组均确定突变小鼠中缺乏的tRNA水平在基因治疗后飙升。Minczuk的团队还测量了一些代谢分子,这些分子表明动物的线粒体工作得更好。
迈阿密大学的TALENs编辑系统
两组研究人员按照同样的思路设计了TALENs编辑系统,这些动物的tRNA变种比正常少,当然它们只会形成一种微妙的症状,即轻微的心脏异常。
在迈阿密大学的研究项目中,Moraes和他的同事Sandra Bacman,以及他们的团队将携带TALENs基因的病毒注射到每只动物右腿的肌肉中。同时作为对照,他们将缺少TALENs基因的病毒注射到同一只动物左侧的同一块肌肉中。实验室培养6个月后,接受TALENs治疗的肌肉中突变线粒体DNA数量减少了50%以上,最终,受损DNA与正常DNA的比例低于通常会引起症状的50:50的阈值。
后期计划人体试验
研究人员一致认为,要在人体中应用该策略,他们必须确保ZFN和TALEN的基因以正确的量到达正确的组织位置。两个研究小组都表示在不远的将来进行人体安全性临床试验。以期达到解除线粒体病患,造福人类的目的。