当人们遭受脊髓损伤时,这会损害轴突并阻止大脑向损伤部位下方的神经元发送信号,从而导致瘫痪和其他神经功能(如如膀胱控制和手部力量)的丧失。轴突是连接我们的神经元并使得它们能够通信的微小神经纤维。
中枢神经系统(CNS)中神经元的细胞骨架由不同的结构蛋白组成,包括微管(MT)和肌动蛋白(F-actin),保持正常细胞功能(如形态、运动、发育、运输)需要依赖于MT和F--actin的动态性。此外,细胞骨架功能障碍是许多CNS损伤和疾病的根本原因,例如,轴突损伤后成人CNS中的细胞骨架动力学不利于生长锥形成、 轴突再生和功能恢复。要了解MT和F-actin细胞骨架在成人CNS损伤恢复中的作用,以及如何调节它们进行轴突再生,需要了解轴突损伤后的细胞骨架动力学1,2。本通讯主要讨论MT和F- actin细胞骨架在成人CNS轴突再生中的作用。
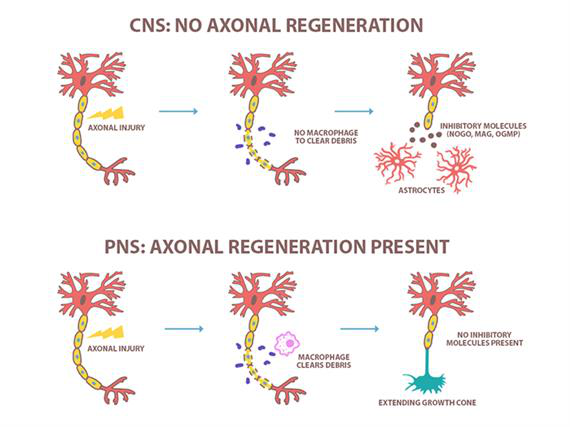
图1. CNS和PNS轴突再生情况
通常情况下我们认为在正常生理条件下成人CNS神经元不发生轴突再生,相反,而周围神经系统(PNS)中受损的轴突会再生。目前造成这种差异的关注点主要集中在成人CNS中的两个显著的再生相关信号通路:1.内源性再生相关基因(RAGs)的激活 2.抑制轴突再生的外部信号1,2。
轴突再生需要成人神经元在受损轴突的尖端形成新的生长锥以启动再生长,这种可塑性需要对MT和F-actin细胞骨架进行动态重组(图2), PNS中的轴突再生对于MTs和F-actin如何参与细胞内和细胞外信号传导起着重要的指导作用,这些信号传导参与了轴突在损伤后的再生过程1,2。重要的是,一旦神经元成熟,中枢神经系统中对神经轴突损伤后的几种细胞反应要么不会发生,要么会严重减弱。
轴突损伤引发钙的流入,会激活一系列钙介导的信号传导途径3-8:包括HDAC5介导的轴突MT的去乙酰化,这是轴突再生所必需的翻译后修饰9-11。另一个依赖于MTs的细胞内损伤诱导的变化是损伤部位局部翻译的蛋白质(例如,各种激酶和转录因子)逆行转运到细胞体进行核定位和预期的RAGs活化1,2。蛋白质合成和MT介导的囊泡、细胞器(例如,线粒体)和RAGs(例如,细胞骨架蛋白,突触蛋白)的顺向转运也会发生1,2,10,12-14。
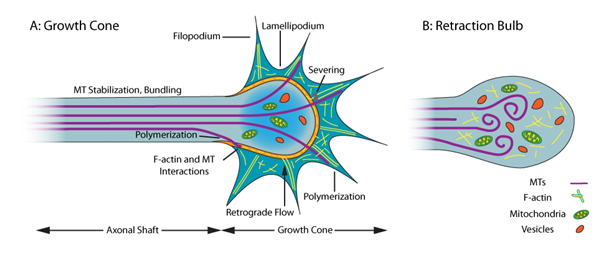
图2.神经元中生长锥和回缩球中的MT及F-actin细胞骨架组织
在再生轴突(左图)中,稳定的MT在轴(C-结构域)中,而生长锥包含动态MT和F-actin(P-结构域)。MT和F-actin的动态特性使得能够形成延长/撤出轴突伸长所必需的片状伪足和丝状伪足。
受损轴突尖端的回缩球(右图)形成阻止轴突再生。在灯泡结构中,独立的结构域丢失, MT要么解聚要么形成无组织MT。
上述损伤诱导的变化对于生长锥形成和受损轴突的再生是必需的(图2)。PNS的受损轴突形成新的生长锥,其由中心(C-)区中的稳定MT和锥体尖端(P-)区的动态MT组成1,2,15。与PNS的再生过程相反,受损中枢神经系统轴突的远端顶端覆盖着一种营养不良的结构,称为回缩球,阻止轴突再生。回缩球由解聚的MTs、无序的MTs组成,没有肌动蛋白和微管蛋白聚合物的单独结构域,也没有稳定、动态的聚合物的有序分布1,2,15(图.1)。
生长锥的MT网络的不稳定性将其转换为类似回缩灯泡的结构。这些研究表明功能失调的MT动力学导致成人CNS神经元在生理条件下受损的轴突无法再生1,2,15,16。正如可以预测的那样,回缩球中MT的稳定导致成人CNS轴突尖端中的MT聚合增加,同时收缩球形成减少,生长锥发育开始1,2,16-19。MT动力学不当调节也会参与到星形胶质细胞和成纤维细胞内生长抑制信号通路中,激活受损轴突处的纤维化瘢痕形成细胞1,16。用紫杉醇稳定MTs后,可阻止成纤维细胞的细胞外基质蛋白和星形胶质细胞的生长抑制蛋白的释放1,16,17,因此,MT参与了轴突的促再生和抗再生功能过程。
肌动蛋白也在成人中枢神经系统对轴突损伤的反应中起作用,但其作用不如MTS。抑制actin结合蛋白(non-muscle myosin II)可导致肌动蛋白细胞骨架的重组显著增加,降低了F-actin水平,增加丝状伪足的形成,并增强MT突起进入P-结构域,这些影响最终导致轴突再生1,20。肌动蛋白影响轴突再生的途径中至少有一种会涉及RhoA GTPase,可能通过将细胞外抑制信号与actin骨架的重组有关1,21-23。
总结:
充分了解如何在轴突再生中对MT和F-actin细胞骨架进行动态调节,对于解决成人中枢神经系统中受损轴突的再生的谜题至关重要。根据目前的研究,MTs和F-actin在成人CNS轴突再生中的作用至少有3条:
1. 增强受损神经元的内在再生能力;
2. 为损伤相关分子和细胞器的顺行和逆行运输提供轨道;
3. 调节参与纤维蛋白合成的分子的释放1。
选择性地激活或抑制MT和F-actin为成人CNS神经元中受损轴突的治疗提供了巨大的潜力。
为了帮助研究者们进行这些研究,艾美捷科技为您推荐Cytoskeleton公司全套的研究工具,包括纯化的actin,tubulin和小G蛋白,以及用于这些蛋白质的功能测定试剂盒以及用于MT和F-actin的活细胞成像试剂。
G-LISA 活化检测试剂盒:
| 产品名称 | 货号 |
| RhoA G-LISA 活化检测生化试剂盒(比色法) | (Cat. # BK124) |
| RhoA G-LISA 活化检测生化试剂盒(荧光法) | (Cat. # BK121) |
Actin生化试剂盒
| 产品名称 | 货号 |
| 肌动蛋白结合蛋白 Spin-Down生化检测试剂盒(兔骨骼肌actin) | (Cat. # BK001) |
| 肌动蛋白结合蛋白 Spin-Down生化检测试剂盒(人血小板actin) | (Cat. # BK013) |
| Actin聚合生化检测试剂盒(荧光法:兔骨骼肌actin) | (Cat. # BK003) |
| G-Actin/F-actin In Vivo生化检测试剂盒 | (Cat. # BK037) |
Tubulin生化试剂盒
| 产品名称 | 货号 |
| Tubulin聚合生化检测试剂盒(比色法) | (Cat. # BK006P) |
| Tubulin聚合生化检测试剂盒(荧光法) | (Cat. # BK011P) |
| 微管结合蛋白 Spin-Down生化检测试剂盒 | (Cat. # BK029) |
| 微管/Tubulin In Vivo生化检测试剂盒 | (Cat. # BK038) |
| 产品名称 | 货号 |
| SiR-Actin Kit | (Cat. # CY-SC001) |
| SiR-Tubulin Kit | (Cat. # CY-SC002) |
| Cytoskeleton Kit (包括SiR-Actin, SiR-Tubulin,和Verapamil) | (Cat. # CY-SC006) |
| SiR700-Actin Kit | (Cat. # CY-SC013) |
| SiR700-Tubulin Kit | (Cat. # CY-SC014) |
iRegene的人源干细胞株及配套培养试剂盒:
| 产品名称 | 货号 |
| NouvNe u™人源神经干细胞(hNSC)细胞株 | (RJC02006) |
| NouvNeu!" hNSC 神经干细胞培养试剂盒 | (RJM02000) |
| NouvNeu™hNeuron神经元定向分化细胞培养试剂盒 | (RJM03000) |
参考文献:
- Blanquie O. and Bradke F. 2018. Cytoskeleton dynamics in axon regeneration. Curr. Opin. Neurobiol. 51, 60-69.
- Mar F.M. et al. 2014. Cell intrinsic control of axon regeneration. EMBO Rep. 15, 254-263.
- Ghosh-Roy A. et al. 2010. Calcium and cyclic AMP promote axonal regeneration in Caenorhabditis elegans and require DLK-1 kinase. J. Neurosci. 30, 3175-3183.
- Udina E. et al. 2008. Electrical stimulation of intact peripheral sensory axons in rats promotes outgrowth of their central projections. Exp. Neurol. 210, 238-247.
- Enes J. et al. 2010. Electrical activity suppresses axon growth through Ca(v)1.2 channels in adult primary sensory neurons. Curr. Biol. 20, 1154-1164.
- Chierzi S. et al. 2005. The ability of axons to regenerate their growth cones depends on axonal type and age, and is regulated by calcium, cAMP and ERK. Eur. J. Neurosci. 21, 2051-2062.
- Trakhtenberg E.F. and Goldberg J.L. 2012. Epigenetic regulation of axon and dendrite growth. Front. Mol. Neurosci. 5,
- Lindner R. et al. 2013. Epigenetic regulation of axon outgrowth and regeneration in CNS injury: the first steps forward. Neurotherapeutics. 10,771-781.
- Cho Y. and Cavalli V. 2012. HDAC5 is a novel injury-regulated tubulin deacetylase controlling axon regeneration. EMBO J. 31, 3063-3078.
- Cho Y. et al. 2013. Injury-induced HDAC5 nuclear export is essential for axon regeneration. Cell. 155, 894-908.
- Gaub P. et al. 2011. The histone acetyltransferase p300 promotes intrinsic axonal regeneration. Brain. 134,2134-2148.
- Fernandes K.J. et al. 1999. Influence of the axotomy to cell body distance in rat rubrospinal and spinal motoneurons: differential regulation of GAP-43, tubulins, and neurofilament-M. J. Comp. Neurol. 414, 495-510.
- Mandolesi G. et al. 2004. Acute physiological response of mammalian central neurons to axotomy: ionic regulation and electrical activity. FASEB J. 18, 1934-1936.
- Zundorf G. and Reiser G. 2011. Calcium dysregulation and homeostasis of neural calcium in the molecular mechanisms of neurodegenerative diseases provide multiple targets for neuroprotection. Antioxid. Redox. Signal. 14, 1275-1288.
- Erturk A. et al. 2007. Disorganized microtubules underlie the formation of retraction bulbs and the failure of axonal regeneration. J. Neurosci. 27, 9169-9180.
- Hellal F. et al. 2011. Microtubule stabilization reduces scarring and causes axon regeneration after spinal cord injury. Science. 331, 928-931.
- Sengottuvel V. et al. 2017. Taxol facilitates axon regeneration in the mature CNS. J. Neurosci. 31, 2688-2699.
- Ruschel J. et al. 2015. Systemic administration of epothilone b promotes axon regeneration and functional recovery after spinal cord injury. Science. 348, 347-352.
- Witte H. et al. 2008. Microtubule stabilization specifies initial neuronal polarization. J. Cell Biol. 180, 619-632.
- Hur E.M. et al. 2011. Engineering neuronal growth cones to promote axon regeneration over inhibitory molecules. Proc. Natl. Acad. Sci. USA. 108,5057-5062.
- Lehmann M. et al. 1999. Inactivation of Rho signaling pathway promotes CNS axon regeneration. J. Neurosci. 19,7537-7547.
- Dergham P. et al. 2002. Rho signaling pathway targeted to promote spinal cord repair. J. Neurosci. 22,6570-6577.
- Fehlings M.G. et al. 2011. A phase I/IIa clinical trial of a recombinant Rho protein antagonist in acute spinal cord injury. J. Neurotrauma. 28,787-796.
Cytoskeleton公司成立于1993年,专注于生物化学和细胞过程研究中的纯化蛋白和便捷试剂盒开发与生产。公司提供药物筛选、信号转导、蛋白质转录后修饰(PTM)、细胞骨架研究相关的系列试剂盒和产品,尤其以细胞骨架相关研究见长,既能满足于样品较少的科学研究,也可以用于小规模筛选研究和高通量大规模筛选研究。此外,公司还提供微管蛋白,肌动蛋白,小G蛋白,GAPs,GEFs等现有产品的药物筛选服务。
iRegene其核心科学团队来自于英国剑桥大学和罗斯林研究所。 秉承“睿知有临,此生长健”的美好愿景,武汉睿健医学旨在利用诱导多能干细胞(iPSC)和基因编辑技术推动人类再生医学健康事业的发展。睿健医学是国内专注于诱导多能干细胞再生领域,集新技术研发,技术服务,再生医学产品生产,销售于一体的高科技创新型公司。
作为Cytoskeleton、iRegene在中国的区域总代理,艾美捷科技有限公司将为中国客户提供最全面的Cytoskeleton、iRegene产品与服务。