病毒基因载体是一种常见的分子生物学工具,其基于病毒的机制,可以有效地将目标基因转运到培养的细胞或完整的生物体中。在当前的研究中,常见的病毒基因载体包括慢病毒载体(Lentivirus Vector,LV)、腺病毒载体(Adenovirus Vector,AdV)以及腺相关病毒载体(Adeno-associated virus Vector)。这些载体都具有独特的特点和适用范围,可以根据具体需求选择最合适的载体来进行基因传递研究。
每种病毒基因载体都有独特的特点,因此它们在应用过程中展示出各自的优势和劣势。此外,它们的应用方向也有所不同。接下来,我们将总结并介绍以下三种病毒基因载体的主要应用和区别:
| 慢病毒(LV) | .用于常规细胞的感染,强大的基因传递工具。 |
| .永久整合到基因组中,便于稳转株的构建,持续传代。 | |
| .可用于转基因动物和动物模型的构建。 | |
| .基因治疗:通过造血干细胞治疗遗传性疾病。例如白血病,地中海贫血等。 | |
| .细胞治疗:CAR-T治疗癌症。 | |
| 腺病毒(ADV) | .对原代细胞和悬浮细胞具有较强的感染能力。 |
| .病毒载体的承载量较大,可插入7.5kb左右。 | |
| .不整合到宿主细胞基因组中,具有瞬时表达的特点,相对比较安全。 | |
| .经常用于感染性疾病以及恶性肿瘤的疫苗开发。 | |
| 腺相关病毒(AAV) | .高安全性和低免疫原性,重组AAV不整合基因组,未发现与任何疾病相关,低 免疫原性。 |
| .AAV有多种血清型,能够特异性感染不同的组织或器官。动物实验的首选。 | |
| .体积小,滴度高,远优于腺病毒和慢病毒的扩散性,可穿透血脑屏障,优秀的 神经元和胶质细胞感染工具。 |
|
| 基因治疗领域常用的病毒载体。 |
| 病毒表达系统 | 腺病毒 (Adenovirus) |
慢病毒 (Lentivirus) |
腺相关病毒 (Adeno-As sociate virus) |
| 病毒基因组 | 双链DNA病毒 | RNA病毒 | 单链DNA病毒 |
| 复制 | 条件复制 | 不可复制 | 条件复制 |
| 滴度 | 最高可达1012pfu/ml | 最高可达109TU/ml | 最高可达1012-13v.g/ml |
| 感染细胞类型 | 感染分裂和不分裂细胞 | 感染分裂和不分裂细胞 | 感染分裂不旺盛的细胞 |
| 表达丰度 | 高水平表达 | 中到高水平表达 | 高水平表达 |
| 表达时间 | 快 (1-2天) | 慢 (2-4天) | 1-2周 |
| 持续表达时间 | 病毒基因组游离于宿主基因组外,瞬时表达外源基因 | 病毒基因组整台于宿主基因组,长时间、稳定表达外源基因 | 病毒基因组游离于宿主基因组外, 在分裂旺盛的细胞中可长时间表达 |
| 克隆容量 | 适合表达小于5kb的外源片段 | 适合表达小于4kb的外源片段 | 适合表达小于2.8kb的外源片段 |
| 免疫原性 | 较高免疫原性 | 低免疫原性 | 低免疫原性 |
| 安全性 | 可能会引起一些咳嗽流涕 | 暂无发现致病性, 已被用于CAR-T治疗作用于人体 |
暂无发现致病性, 已通过欧盟和FDA许可, 用作基因治疗药物的载体 |
下面看详细的讲解
一、慢病毒:
慢病毒(Lentivirus)是逆转录病毒的一种,基因组为双链RNA,慢病毒载体是一类改造自人免疫缺陷病毒(HIV)的病毒载体,其毒性基因已经被剔除并被外源性目的基因所取代,属于假型病毒。慢病毒能够将靶基因导入到一些较难转染的细胞,如原代细胞等,并且将靶基因随机整合到宿主的基因组中,能够在细胞系中稳定表达若干代,可以进行稳转细胞株的筛选。具有感染分裂期与非分裂期细胞的特性。
慢病毒表达载体包含了包装、转染、稳定整合所需要的遗传信息。慢病毒包装质粒可提供所有的转录并包装RNA到重组的假病毒载体所需要的所有辅助蛋白。为产生高滴度的病毒颗粒,需要利用表达载体和包装质粒同时共转染细胞,在细胞中进行病毒的包装,包装好的假病毒颗粒分泌到细胞外的培养基中,离心取得上清液后,可以直接用于宿主细胞的感染。

慢病毒形态:病毒粒子被来自宿主细胞的磷脂包膜包裹,病毒糖蛋白(gp41和gp120)对病毒进入细胞很重要。病毒基因组进一步受到由p24蛋白形成的衣壳的保护,并且病毒具有两个额外的结构蛋白p17和p7。所有这些结构蛋白对于病毒复制周期中的基本功能很重要。在病毒中发现的其他成分包括逆转录酶,介导病毒RNA基因组转化为病毒DNA;整合酶,介导前病毒DNA基因组整合到宿主细胞基因组中;以及在病毒成熟过程中负责加工gag和gag-pol多蛋白的病毒蛋白酶。
HIV-1具有约9kb大小的单链阳性RNA基因组,具有编码九种病毒蛋白质的三个主要开放阅读框。每个病毒颗粒都有两个相同的基因组RNA正义拷贝,每个拷贝都编码病毒复制所需的全部信息。最近的研究表明,这两个拷贝都是成功完成所必需的。病毒基因组的边缘是长末端重复序列(LTR),每个序列包含三个区域,即U3、R和U5,它们对于转录、逆转录和整合至关重要。
慢病毒的优势:
1. 慢病毒携带的基因组可整合到宿主基因组,使宿主细胞长时间稳定表达外源基因;2. 可感染分裂和非分裂细胞;
3. 低免疫原性,直接注射活体组织不易造成免疫反应,适用于动物实验;
4.可以更换特异性启动子;
5. 野生型的HIV大小约为9.8 kb,插入片段可长达5-6 kb。
二、腺病毒:
腺病毒基因组及其携带的外源基因不会整合入宿主细胞的基因组中,而是游离于宿主基因组外独立表达,因此可实现目的基因瞬时、高丰度的表达,同时还避免了因整合而引发的潜在的基因突变和随机效应,安全性和可控性高。
腺病毒(Adenovirus,Ad)是一种球形、无包膜病毒,直径约70~90nm,衣壳呈20面体立体对称结构,由252个壳粒组成,其中240个为六邻体(Hexon),另外12个为五邻体(Penton),位于衣壳表面的纤维状刺突是以五邻体蛋白为基底,由衣壳表面伸出的12根纤毛(Fiber),纤毛顶端形成头节区(Knob),五邻体和纤毛的头节区可与细胞表面的受体结合,在病毒感染细胞过程中起着非常重要的作用。腺病毒的基因组为线性的、非分段的双链DNA(dsDNA),大小约25~45kb,主要包括病毒DNA复制前期的E1a、E1b、E2a、E2b、E3、E4(编码病毒调节蛋白)和DNA复制后期的L1~L5(编码病毒结构蛋白)。Ad的复制不依赖于宿主细胞的分裂,且宿主广泛,可感染分裂和非分裂细胞,具有嗜上皮细胞性,可通过自身纤毛的头节区与细胞表面的特异性受体结合被内吞进入细胞,然后从内吞体(Endosome)转移到细胞质和细胞核内,借助细胞的转录和翻译机器启动病毒的复制组装。

目前已知的腺病毒有52种,分别命名为Ad1~Ad52,其中Ad5是目前常用于改造成复制缺陷的腺病毒载体(Adenoviral Vector,AdV)的一种,其基因组是一个线性的36kb的dsDNA分子。Ad5缺失了腺病毒早期表达的基因序列E1和E3,其中,E1是腺病毒复制所必须的,因此,E1缺失使Ad不能完成自身复制,只能依靠包装细胞提供的反式互补方式进行复制扩增;E3编码的是细胞表面的一种糖蛋白,可对抗宿主的抗病毒防御系统,因此,E3的缺失可减少宿主免疫反应。近年来,腺病毒载体作为一种常用的基因操作工具,已被广泛用于基础研究、疫苗载体及基因治疗研究领域。
腺病毒的优势:
1. 是研究原代非增殖细胞基因表达的最佳系统:腺病毒感染细胞后,1-2 天即可表达;
2. 滴度高:腺病毒系统在转有 E1 基因的 HEK293 细胞中可进行自我复制,可产生滴度为1010 到1011PFU/mL 的病毒;
3. 载体容量大:可容纳不超过5kb 的片段;4. 不整合到染色体中,无插入致突变性:腺病毒除卵细胞以外,几乎在所有已知细胞中都不整合到染色体中,因此避免了因整合而引发的潜在的基因突变和随机效应。
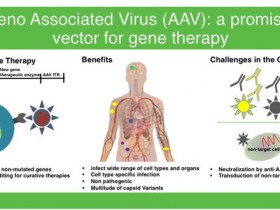
三、腺相关病毒:
腺相关病毒(Adeno-Associated Virus,AAV)是一种小型无包膜病毒,属于细小病毒科,1965年从腺病毒分离株的污染物中首次被发现,外部呈现20面体结构,直径约26nm,其衣壳蛋白由VP1、VP2和VP3三种蛋白构成。AAV的基因组是一条单链线性DNA,约4700bp,包括上下游两个开放阅读框(ORF):Rep和Cap,位于分别由145个核苷酸组成的2个T形反向末端重复序列(ITR)之间。ITR的作用是充当病毒复制起点和包装信号,Rep基因参与病毒复制和整合,编码病毒复制蛋白,Cap基因负责编码病毒三个衣壳蛋白。自然界中存在的天然野生型腺相关病毒,基因组上存在Rep和Cap基因,而实验用的AAV载体,是在野生腺相关病毒的基础上经过人工改造的质粒,基因组上没有Rep和Cap基因,因此也叫重组腺相关病毒(recombinant AAV,rAAV)。在没有特别指出的时候,简称AAV一般指已经改造过的AAV载体。

AVV有许多血清型,目前已从人和猴体内分离出12种AAV血清型,不同AAV血清型具有不同的衣壳蛋白空间结构、序列和组织特异性,因而其识别与结合的细胞表面受体也有很大差别,这也导致不同血清型转染的组织类型、细胞类型和感染效率各不相同,在应用AAV病毒过程中需要根据不同组织器官选择相应血清型的AAV病毒。
由于腺相关病毒具有宿主范围广、安全性高、免疫原性低、表达稳定和物理性质稳定等优点,已被广泛地应用于基础研究和临床试验中,并且腺相关病毒载体已成为世界上最常用的基因治疗载体之一。
腺相关病毒的优势:
1、安全性高:迄今从未发现野生型AAV对人体致病,重组AAV是三质粒系统,基因组序列上去除了大部分的野生型AAV基因组元件,只有ITR序列,其他各个基因由独立的质粒表达,进一步保证了安全性;
2、免疫原性低:AAV2的基因组仅4681个核苷酸,便于用常规的重组DNA技术进行操作,而且进行动物实验时造成的免疫反应小,AAV感染组织后很少会被免疫系统清除;
3、宿主范围广:可以感染广泛的哺乳动物并且成功应用于人类和非人类蛋白的表达,不仅可转染分裂细胞,也可转染非分裂细胞;
4、多种血清型:AAV1~AAV9以及DJ、DJ/8、Rh10等12种血清型,不同血清型的AAV可以靶向不同的细胞和组织;
5、表达稳定、持续时间长:不整合到宿主基因组,可长期稳定表达外源基因,在宿主细胞中形成附加体(episome)存在于细胞核中,体内可持续表达6个月以上;
6、扩散性强:与慢病毒和腺病毒相比,AAV可以穿透血脑屏障,是最适合用来感染神经元和胶质细胞的。
AAV缺点:
1、载体容量小:可插入序列比慢病毒要小很多,目前最多只能容纳不超过3kb的外源DNA片段;
2、体外实验表达水平较低:主要是因为rAAV病毒的基因组是单链DNA,在体外环境形成双链并转录翻译外源基因的效率非常低。可以在体外水平感染rAAV病毒的同时感染辅助病毒比如Ad5型腺病毒或者终浓度10~50mM的dingsuan钠等方法提高细胞实验的rAAV表达量;
3、表达速度慢:相比较慢病毒和腺病毒而言,rAAV在感染后需要较长的时间来表达外源基因,一般在感染两周后才表达,因为需要从单链DNA变成双链DNA。