1、Science:根除潜伏在被感染免疫细胞内的HIV的新方法
2021年2月4日,来自美国华盛顿大学医学院Liang Shan课题组在学术期刊《科学》杂志上发表了题为“CARD8 is an inflammasome sensor for HIV-1 protease activity.”的一项新突破研究成果。他们发现CARD8是针对HIV-1蛋白酶活性的炎症小体传感器。
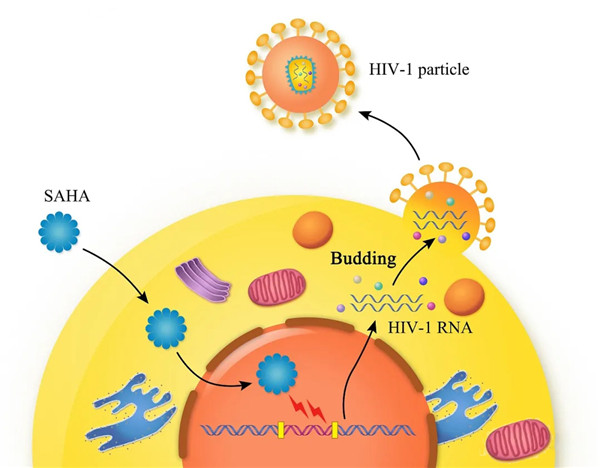
Fig 1|来源science
CARD8炎症小体感知HIV-1蛋白酶的活性。HIV-1可以逃避对CARD8的感知,HIV蛋白酶在受感染的细胞内没有任何功能。病毒蛋白酶只有在病毒离开受感染的细胞后才被激活。在细胞外,没有CARD8可以检测到活性蛋白酶。病毒蛋白酶在细胞内过早活化触发了HIV-1感染细胞时CARD8炎症小体介导的细胞凋亡。这种策略导致病毒再激活后清除患者CD4 + T细胞中潜在的HIV-1。
因此,他们的研究确定CARD8是HIV-1的炎症小体传感器,有望将其作为清除持续性HIV-1感染的策略。
据悉,HIV-1的突变率很高,并以突变群的形式存在于宿主体内。HIV-1的快速进化使病毒感染速度超过了宿主的免疫系统,从而导致了病毒的持久性。需要针对不可变成分的方法来清除HIV-1感染。
(评论:CARD8炎性小体可以触发感染了世界各地HIV亚型的人类免疫细胞的死亡,其中包括在北美,欧洲,非洲和亚洲常见的菌株。)
文章来源:
Qiankun Wang, Hongbo Gao et al, CARD8 is an inflammasome sensor for HIV-1 protease activity. DOI: 10.1126/science.abe1707, Science:最新IF:41.037
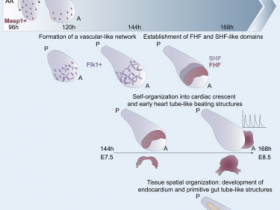
2、Nature Biotechnology:人类心脏类器官可重现早期心脏和前肠的发育
2021年2月8日,来自德国汉诺威医学院Robert Zweigerdt、Lika Drakhlis等研究人员合作在学术期刊《自然—生物技术》发表了题为“Human heart-forming organoids recapitulate early heart and foregut development.”的研究论文,发现人类心脏类器官可重现早期心脏和前肠的发育。
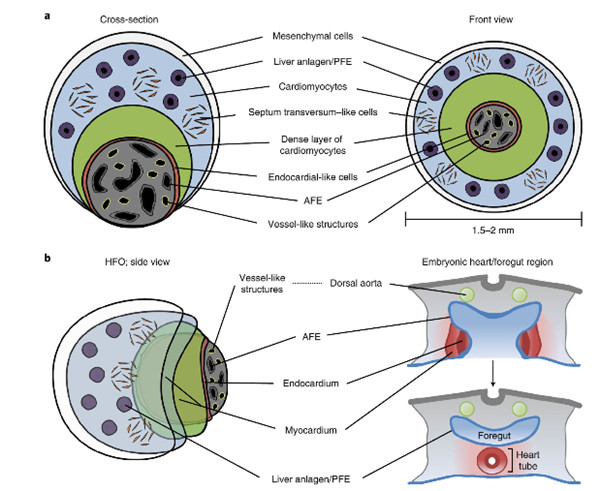
Fig 2| HFOs resemble early heart and foregut anlagen
通过将人类多能干细胞聚集体埋入基质胶中,然后通过小分子的双相WNT途径调控定向心脏分化,研究人员获得了复杂的、高度结构化的三维心脏形成类器官(HFO)。HFO由一层内膜样细胞内衬并被中隔横隔样结构包围的心肌层组成。它们还包含在空间和分子上截然不同的前肠内胚层组织以及血管网络。HFO的结构与心管形成之前的早期天然心脏结构非常相似。
通过揭示NKX2.5基因敲除的HFO表型与转基因小鼠中心脏畸形表型的相似性,研究人员证明HFO可被应用于体外遗传缺陷的研究。
据介绍,肠、脑、肾和其他器官已经建立了早期组织发育的类器官模型,但是缺乏心脏的类似方法。
(评论:建立了一个可以诱导人多能干细胞形成自主装的心脏形成类器官的稳健实验方法,成功构建的概率为88%。该心脏形成类器官可以形成具有心脏结构不同细胞层模式同时又具有前肠内胚层的结构。)
文章来源:
Lika Drakhlis, Santoshi Biswanath et al, Human heart-forming organoids recapitulate early heart and foregut development. DOI: 10.1038/s41587-021-00815-9, Nature Biotechnology:最新IF:31.864
3、Cell:IL-12和IL-23受体共享结构基础揭示抗肿瘤免疫机制
2021年2月18日,来自美国斯坦福大学医学院K. Christopher Garcia研究团队在期刊《细胞》杂志发表了题为” Structural basis for IL-12 and IL-23 receptor sharing reveals a gateway for shaping actions on T versus NK cells。”研究成果,发现介素12(IL-12)和IL-23受体共享的结构基础揭示了靶向T细胞与NK细胞形成作用的途径。

Fig 3| 来源cell
他们提出了四级IL-23(IL-23p19 / p40)/ IL-23R /IL-12Rβ1复合物的晶体结构,以及完整的IL-12(IL-12p35 / p40)的冷冻电镜(cryo-EM)图)/IL-12Rβ2/IL-12Rβ1和IL-23受体(IL-23R)复合物,它们揭示了“非规范”拓扑结构,其中IL-12Rβ1直接与常见的p40亚基结合。他们靶向共享的IL-12Rβ1/ p40界面设计了一组IL-12部分激动剂,这些激动剂可保留CD8 + T细胞对干扰素γ(IFNγ)的诱导作用,但会削弱体外自然杀伤(NK)细胞产生的细胞因子。
这些细胞偏好特性在体内得到了概括,其中IL-12部分激动剂引发了靶向MC-38鼠腺癌的抗肿瘤免疫力,而没有野生型IL-12所见的NK细胞介导的毒性。因此,IL-12家族细胞因子所使用的受体共享的结构机制为调节该细胞因子轴提供了治疗所需的蛋白质界面蓝图。
(评论:IL-12和IL-23是异源二聚体细胞因子,由抗原呈递细胞产生,以调节淋巴细胞的激活和分化,它们共享IL-12Rβ1作为受体信号亚基。)
文章来源:
Caleb R. Glassman, Yamuna Kalyani Mathiharan et al, Structural basis for IL-12 and IL-23 receptor sharing reveals a gateway for shaping actions on T versus NK cells.
DOI: 10.1016/j.cell.2021.01.018, Cell:最新IF:36.216