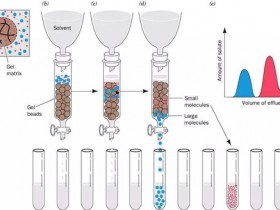
为了成功地分离样品,必须根据样品特性和分离目的合理地设计出分离纯化实验方案。在设计实验方案时,应当考虑的因素主要包括凝胶过滤介质或预装柱的选择,洗脱剂的选择,层析柱尺寸的控制,以及层析过程中有关参数的确定。
1、凝胶过滤介质的选择
1.1、分离目标和凝胶过滤介质的特性
1)根据分离样品的数量和目的,生化分离过程分为分析型和制备型分离。
2)分析型分离中样品的量较少,分离目的包括目标分子纯度测定,分子量测定,分子量分布分析,获取微量的目标分子等。
3)制备型分离涉及样品的量相对较多,分离目的包括对样品进行脱盐和缓冲液交换,去除混合物中的某些杂质,实验室小规模的获取目标物质,以及工业化制备某种物质等。
4)凝胶颗粒大小有粗、中、细、超细等,其颗粒直径依次减小。一般情况下,粗规格的凝胶适合于对数量较多的样品进行分离,中规格的凝胶适合于少量、微量样品的制备,常规分析和测定,而细和超细规格的凝胶则适合于微量和极微量样品的分析。
1.2、选择性曲线和分离范围
1)待分离物质的分子大小是决定选用何种介质的最重要因素,绝大多数情况下,所选凝胶的分级范围应当涵盖目标分子的大小。只有在这种情况下,介质才能对目标分子和其他大小不同的杂质分子表现出不同的选择性(α),从而进行有效分离。
2)凝胶介质的选择性曲线对于指导凝胶的选择有很大帮助。选择性曲线是凝胶的重要参考指标,一般是通过溶质的有效分配系数Kav对溶质的分子大小作图得到。有时也可以用溶质的洗脱体积Ve对分子大小作图。
1.3、样品和洗脱剂的特性
1)在分子量相同的情况下,分子形状不同的物质分配系数和洗脱体积相差很大。每种介质的选择性曲线都有针对球状蛋白和针对葡聚糖两种,应根据目标分子的形状更接近球状蛋白还是线型的葡聚糖来确定其适合哪种选择性曲线,进而决定介质类型。
2)在目标分子的分子量或分子形状未知的情况下,一般可以先选择分级范围较宽,有着较高排阻限的介质来进行分离。
2、洗脱剂的选择
1)凝胶过滤层析中所用流动相即洗脱剂通常不对选择性产生影响,从理论上讲,如果所分离物质不带电荷,可以直接用蒸馏水进行洗脱,实际操作时,当对较大体积的样品进行脱盐实验时,也的确有用蒸馏水洗脱的例子。然而绝大多数情况下人们考虑用缓冲液而不是蒸馏水来作为洗脱剂。
2)选择缓冲液时首先要考虑的是在纯化过程中维持合适的pH,在此pH下目标分子稳定性良好。大多数凝胶过滤在中性pH附近进行,此时建议使用缓冲能力在pH6-8的水相缓冲系统,此环境对多数生物分子及介质都是适宜的。
3)有的凝胶介质本身会带有少量的负电荷,这会对按分子大小分离的凝胶过滤层析结果产生影响,为了排除这种影响,洗脱剂通常需要具有一定的离子强度,通常0.15mol/L的离子强度足以排除溶质与介质之间任何的离子作用。
3、层析柱的选择
1)柱壁材料结实、化学惰性,能够承受一定的操作压力,在常规的层析条件下保持稳定,不与样品及洗脱剂发生相互作用。
2)层析柱的入口和出口部分的死体积尽可能小,低于柱体积的0.1%,这样可以使样品的稀释程度最小化,同时防止已经分离的样品区带在柱下端重新混合。
3)柱内有设计合理的凝胶床支持物,既能有效的支撑凝胶床,又不易被堵塞,保证液流能够均匀的通过。
4)容易拆卸,方便清洗,最好配件具有通用性。
5)实验室常用的凝胶过滤柱的内径大多在4-16mm,而柱长大多在25-100cm。

当实验方案设计完成后,就需要着手对选择好的凝胶介质、层析柱、洗脱剂、样品等进行准备,装柱,平衡,加样,洗脱,样品检测并收集,层析柱的清洗和再生。
1、凝胶的准备
1)如果介质是以已溶胀好的形式出售的,此类介质一般也无需预处理,使用前静置使介质沉降,倾去上清液,按湿胶:洗脱剂(v/v)=3:1的比例添加洗脱剂,搅匀后即可装柱。
2)如果介质是以固态干胶形式出售的,在使用前需要进行溶胀。溶胀是介质颗粒吸水膨胀的过程,膨胀度(得水值)与基质种类、交联度及洗脱剂种类等有关。为了填充一根选定的层析柱需要称取多少量的干胶是可以计算的:
干胶用量(g)=πr2h/膨胀度(床体积ml/g干胶)
2、装柱
2.1、填充过程
1)装柱质量的好坏直接影响到分离效果,填充不好的层析柱会导致柱床内液体流动不均匀,造成区带扩散,大大影响分辨率,也会对层析流速产生影响。
2)装柱过程应避免在通风和日光直射的环境中进行,以防温度改变造成层析柱内产生气泡。层析柱应在支架上垂直放置。装柱之前先用洗脱剂将层析柱底部死空间内的空气排空。
3)将已处理好的介质放置在烧杯中,倒掉过多的液体,大致使得沉降介质:上清液(v/v)=3:1.
4)介质太稠在装柱时容易有气泡产生,而介质太稀则很容易在柱中形成多个界面,造成很差的填充效果。
5)将介质悬液轻微搅拌混匀,利用玻棒引流尽可能一次性将介质倾入层析柱,注意液体应沿着柱内壁流下,防止有气泡产生。
2.2、填充质量的评估
1)装柱完成后,在进行层析之前应当对装柱情况进行检查,简单的方法是将柱子对着亮光,利用透过光检查柱床是否规整,是否有气泡或界面存在。
2)也可以通过对有色物质进行层析并观察区带情况来实现,观察有色区带通过凝胶床时的变化情况可以检验填充效果,填充良好的凝胶柱在洗脱时区带保持均匀、平稳的向下移动。
2.3、柱的平衡
1)平衡的目的是为了确保层析柱中凝胶颗粒网孔和间隙中的液体与洗脱剂在组成、pH和离子强度等方面达到完全一致,这样在加样和洗脱过程中就能使待分离组分始终在所需的溶液环境中,有利于目标分子活性的保持和层析行为的稳定性。
2)人们通常采用2-3个床体积的洗脱剂通过层析柱来确保其完全达到平衡。
3、样品和洗脱剂的准备
1)洗脱剂配制时采用的试剂应当是分析纯,而所用的水应当为纯水。洗脱剂配制完毕,使用前最好对其进行过滤。
2)层析前样品如果是固体,可以将其溶于一定体积的洗脱剂中,如果样品室液体,则可以直接加样。为了延长介质的使用寿命和保持高的分辨率,样品中同样必须无颗粒状物质存在。
3)样品的粘度是影响上样量和分离效果的一个重要方面。
4)如果样品粘度过高是由于浓度造成的,用洗脱剂或水稀释样品可以达到降低粘度的目的。
5)如果粘度是样品中核酸等杂质引起的,可通过添加大分子聚阳离子化合物,如聚乙酰亚胺或鱼精蛋白硫酸盐将其沉淀,或添加核酸内切酶来降低粘度,但这些物质无疑会成为额外的杂质。
6)如果样品粘度非常高的话,也可以通过往洗脱剂中添加蔗糖或葡聚糖增加洗脱剂的粘度来补偿。
4、加样
当层析柱准备好且平衡完成,样品和洗脱剂准备完毕后,就可以开始加样和洗脱了。加样过程是将一定体积的样品添加至层析柱顶端,并使其进入凝胶柱。
4.1、加样量的选择
1)在进行层析时样品的添加量主要受分辨率的限制,因为分辨率Rs与样品体积/柱体积之比有关,样品体积/柱体积的比值增大会导致分辨率下降。
2)对于分析型分离和难度比较大的分级分离,样品体积/柱体积之比必须很小,此时加样体积应为床体积的0.5-5%,更小的加样比例并不能进一步改善分辨率。
4.2、加样方法和注意事项
1)加样时将一定体积的样品溶液添加至柱床的床面,依靠重力或泵提供的压力使样品进入床面的过程。在加样过程中样品溶液应尽可能均匀添加至床面,这样在柱床的横截面上样品能够均匀进入,另外要防止液流破坏床面的平整性,否则会造成区带形状变差,洗脱峰变宽,从而对分辨率产生很大影响。
2)加样的方法有多种,如果采用的是成套液相层析系统,一般都提供标准的加样方法,如通过进样器或注射器等,最终利用泵将样品溶液加入柱床。
3)对于不带有可调接头的传统填充柱,常见的加样方法有排干法和液面下加样法。
4)排干法是加样前先将层析柱上口拧开,让床面之上的液体靠重力作用自然排干,当床面刚好暴露时将层析柱下端阀门关闭。阀门的关闭时机必须选择恰当,过早关闭床面上仍留有少量液体会对样品产生稀释作用,关闭过晚会导致床面变干。
5)用吸管将样品轻轻铺加到床面上,注意不能破坏床面的平整,以免造成区带的扭曲和倾斜,然后打开柱下端阀门,受重力作用样品溶液进入床面,当样品刚好完全进入时关闭阀门。
6)最后用洗脱剂充满层析柱内床面上端空间,拧紧层析柱上口,即可以用恒流泵泵入洗脱剂开始洗脱。
5、洗脱
1)当加样完毕并且样品进入层析柱后,应当立即用洗脱剂对样品进行洗脱,以防样品在层析柱中扩散。通常洗脱过程以一个恒定的流速使洗脱剂通过层析柱,而这个恒定流速由静水压或者泵来控制。
2)凝胶过滤层析时可采用的最大流速受到多种因素的限制,其中最为关键的因素是介质的强度,流速不能超出该介质的最大流速限制。
3)在分析型分离时对分辨率的要求较高,因此通常会采用相对较低的流速。
6、样品的检测、收集和处理
1)样品进行层析时,各组分的分离情况,目标分子的洗脱情况等都反映在层析图谱中,在层析图谱中,横坐标是时间或洗脱液体积,纵坐标是检测器的读数。
2)根据样品中组分性质的不同,有多种不同的检测器可供选择。最常用的是紫外(UV)检测器,可以在两到三个固定的波长如280nm、254nm、214nm下测定洗脱液的吸光度。
3)一般来说人们需要获得分离后的样品,因此需要收集通过层析柱的洗脱液。
4)对于最简单的样品分离,可以采用手工收集的方法,观察到层析图谱中出现洗脱峰时开始收集,到洗脱峰结束时终止收集。
5)液相层析系统一般都配置了分部收集器来对样品进行收集。收集的模式可以有多种,常用的是按规定的时间或洗脱液体积进行分部收集,也可根据检测器检测到的洗脱情况按洗脱峰进行收集。
7、凝胶过滤介质的再生、清洗和贮存
1)理论上来说,在洗脱剂具有一定离子强度的情况下,样品中所有组分都应当在一个柱体积内被洗脱,当洗脱液体积超过一个柱体积时洗脱即可停止,但实验中通常会使用1.5-2个柱体积的洗脱剂来完成洗脱过程。
2)在清洗方法上,最为常规的是采用碱洗,根据介质的pH稳定范围(短程)不同,用0.1-0.5mol/L的NaOH溶液对介质进行清洗除去污染物。
3)浸泡在溶液中的层析柱和介质在很少使用的情况下容易出现微生物生长的现象,尤其是葡聚糖和琼脂糖类型的凝胶介质,易于感染会分泌糖苷酶的微生物,导致基质聚合物中的糖苷键降解而破坏了介质的结构。因此,无论是层析柱还是介质,在长期不使用时,不建议浸泡在对于微生物生长来说营养丰富的缓冲液如磷酸盐缓冲液中,另外,在其浸泡的溶液中添加适当的抑菌剂是必须的。