药物研发是高度复杂的系统工程,小编在这里把临床前阶段流程梳理一下,让同学们可以简易快速了解重点,这么实用文章,对此感兴趣的你一定要收藏!
无论是代表小分子化合物药物的新化学实体(NCEs)还是代表生物大分子药物的新分子实体(NMEs)或新生物实体(NBEs),评价药物的基本标准是安全、有效、可控。药物的研发及生产除涉及到复杂的科学、技术、工艺、质量标准等一系列自身的内在问题外,也涉及到审评标准、流程、法规、伦理等外部控制问题。因此,药物研发是一个高度复杂的系统工程。与小分子化合物药物相比,生物大分子药物结构更复杂,轻微的生产改变常常会造成药性的巨大差别,质控标准复杂、生产工艺精细,因此其研究除具有与小分子化药相同的共性外,还有一些独自的特性。
新药开发的许多环节可外包给专业的合同研究组织完成,如按GLP要求的药效、毒理评价、药代动力学分析及临床试验等。但疾病相关的靶点(也称为靶标,靶分子)的确定及验证,具有生物活性的NEEs/NMEs的设计和优化等核心问题需要自己解决,这也是新药开发的两个重要瓶颈。大多数药物研发失败的原因就是缺乏对药物作用机理的研究以及不能对人体代谢的安全性能更做出很好的预测。
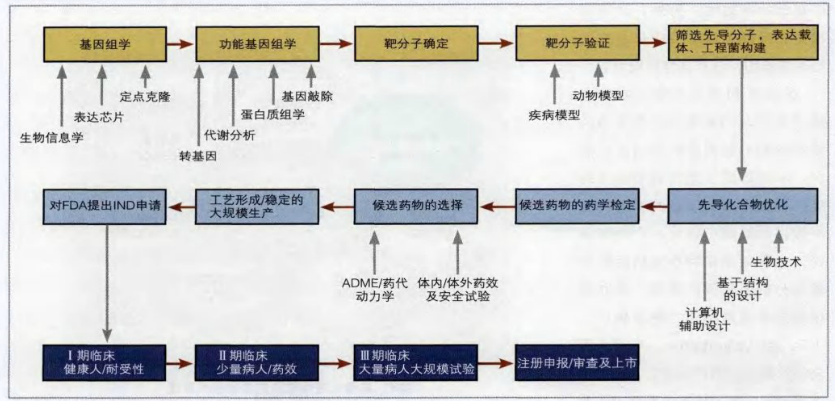
一、药物靶点的发现及其选择
一旦选定一种潜在的可治疗性疾病作为研究目标之后,就需要识别与疾病相关的靶分子,即确定有特殊生物活性且有潜在治疗作用的分子(通常是蛋白质)。药物靶点发现与确证的一般流程包括:①寻找疾病相关的生物分子线索;②对相关的生物分子进行功能研究,以确定候选药物作用靶标;③针对候选药物作用靶点,在分子、细胞和整体动物水平进行药理学研究,验证靶标的有效性。另外,还可以根据已经确证有活性的化合物进行受体垂钓,寻找其作用靶点。
分子生物学及生物技术的卓越成就使人们能鉴定出在普通及特殊细胞中起关键作用的多种蛋白,从而形成了如何调节特定的疾病相关蛋白的功能的假说。这些假说的基础可以是一个科学理论,也可能是由特殊疾病组织的基因分析所获得的信息。建立假说的过程通常称为“靶点确认”。尽管人类全部的基因图谱已经完成,但仅从这些测定序列的基因中发现可能的药物作用靶标并非易事。目前人们共发现具有药理学意义的药物作用靶点大约500个,而根据人类基因组学计划研究成果估计,人体内可能的药物作用靶点大约有5000个以上,更多的药物作用靶点有待于进一步挖掘。目前应用于新药靶点发现的技术有基因组学技术、蛋白质组学技术以及生物信息学技术。基因组学技术包含差异基因表达(DGE)、表达序列标签(EST)等技术。蛋白质组学技术在蛋白质水平上研究疾病状态以及正常状态下的细胞或组织的蛋白质差异变化,可以发现潜在的药物靶蛋白,也有人称化学基因组学是蛋白质组学和疾病治疗间的桥梁。无论是靶基因还是靶蛋白,其与疾病间的关系尚不清楚,但是作为潜在的药物靶点并不影响其对小分子配体的亲和选择作用,在疾病细胞或动物模型的活性检测及临床研究中可以进一步了解靶点与疾病间的关系,实现对靶基因或蛋白的功能分析,从分子水平上揭示疾病机理及其治疗机制。基因敲除模型在基因功能和药物作用新靶点的发现方面具有高度价值,同时也有助于确定药物作用于特定靶点后的不良反应。目前正在系统地敲除鼠固有基因并根据哺乳动物生理学特点确定它们在体内的功能,这一研究足以覆盖几乎所有的蛋白质和可用于药物研究的基因家族,如离子通道、核激素受体、蛋白酶、磷酸二酯酶、激酶、磷酸酶及其它关键的酶类。在制成基因敲除小鼠模型后,可以采用一个初级的表型筛选来确定药物在心脏、脂代谢、免疫、神经、精神病、眼科、骨科、生殖和肿瘤学中的作用靶点。
药物发现中的靶点选择过程是由科学、医学、财务、市场、法规及战略性思考间的复杂平衡决定的。药物失败的一个主要原因就是开发初期对药物靶点生物学功能的认识不足或错误理解。因此,“确定”靶点,识别并确认其生理学、病理学的重要性是药物开发阶段极其重要的一个部分。一般选择药物作用靶标要考虑两方面的情况:首先是靶标的有效性,即靶标与疾病确实相关,并且通过调节靶标的生理活性能有效地改善疾病症状;其次是靶标的副作用,无论与疾病多么相关,如果对靶标的生理活性的调节不可避免地产生严重毒副作用,那么将其选作药物作用靶标也是不合适的。在具体靶点选择上要充分考虑旧靶点与新靶点、已有药物与尚无药物、靶点作用单一与靶点作用复杂、靶点作用在上游与靶点作用在下游等多因素的影响及优劣。
二、新分子实体筛选
一旦靶点的生物学功能被明确下来,就必须找到一种与靶点准确结合的药物(NMEs/NBEs),并与该靶分子进行生物学效应实验。设计和筛选NMEs/NBEs是非常艰巨的任务,需要多方面的知识、技术、信息、甚至艺术的组合,有时也需要耐心和运气。理论上,计算机不仅可以预测药物与结构已知靶点的匹配度,还可以从最开始为靶点量身定做药物。靶点的结构越复杂,模拟药物的相互作用就会越困难。最有希望的NMEs/NBEs将被挑选出来并优化成符合药物特性的形式。这些优化符合药物特性的形式。这些优化后的NMEs/NBEs被称为“先导化合物/分子”。然后要在分子、细胞和整体动物水平进行药理学研究,在人类疾病的动物模型中观察疗效,并进行安全评价。验证靶标的有效性。如果一切进展顺利,最终将进入人体临床实验。如果NMEs/NBEs的毒性太大,即使最有希望的候选药物也是要被淘汰的。分析前导化合物的一个重要环节是通过ADMET(指药物的吸收、分布、代谢、排泄与毒性)弄清药物在体内作用的过程。早期的ADMET研究可利用动物进行,但由于动物模型的局限性,特别是针对人类使用的重组蛋白质药物对动物来说都是抗原性较强的大分子,因此多数结果只有在人类临床实验时才会变得清晰。从理想上来说,毒性研究应在较早的开发阶段完成,但对大分子药物来说,到目前为止还是很难做到的。
选择何种类型的NBEs作为药物候选者对药物开发成功率有较大影响。激素及治疗性酶制剂类药物多为功能活性明确,用位点清楚并且局限,对符合适应症的特殊疾病群体(也包括一些罕见疾病的孤儿药)具有不可替代性,甚至部分需要终生依赖服用。尽管随着功能基因组学、蛋白质组学和代谢组学等研究的深入,越来越多的蛋白质与疾病的关系将被揭示,但可作为该类药物开发的候选蛋白分子将越来越少。细胞因子和生长因子具有微量强效、作用快速、多短期使用等特点,可满足如增强造血及免疫功能、止血及抗凝血、平衡内分泌紊乱、调节生育及生长过程等临床需求,临床效果显著。但由于体内多数细胞因子、生长因子的生物活性广泛、作用靶点多元,其药学作用延伸可引起复杂的生物效应,甚至毒副作用,将限制其成为药物的潜能。而目前已知的作用位点单一的分子(如刺激红细胞生成、促进白细胞增殖的细胞因子等)多数已经开发成为药物。可以预料,该类蛋白质药物的开发难度将越来越大。但由于该类药物的专利基本已经过期,随着生物仿制药/生物相似药法规的统一和完善,该类品种的仿制及改构将有较大的发展潜力。
人类一直在实践中探讨应用天然存在的非人源蛋白质来治疗人类疾病,该组药物就是指在人体内不存在或即使存在但通常不行使蛋白功能的蛋白质药物,包括某些有新功能的外源蛋白及只在特定时间或机体特定部位发挥功能的内源蛋白。例如,对大分子酶促降解的胶原酶、透明质酸酶,对小分子代谢物酶促降解的聚乙二醇化天冬酰胺酶,将血浆酶原降解为血浆酶的链激酶,凝血酶抑制剂重组水蛭素等。该类药物未来的发展主要依赖于对各种新的外源蛋白质在人类生理及药理学功能方面的进一步认识。另外,由于外源大分子蛋白多具有较高的免疫原性,将在很大程度上限制了该类药物的开发及应用。
单克隆抗体及抗体融合蛋白(也称免疫球蛋白相关分子)可直接干扰靶分子或靶组织功能,针对靶点范围广泛、疗效确切,已经涉及到肿瘤及相关疾病、自身免疫性疾病、感染性疾病、器官移植、过敏性疾病、血液疾病、呼吸性疾病等多种疾病领域,是目前市场份额最大,研究最多未来最有发展前景的群体。
为得到更好的药代动力学,弥补某些体内功能蛋白的缺陷或增加蛋白在人体内的功能,对天然蛋白结构进行改造或修饰是有效途径。各种修饰多从改变重组蛋白质的性状入手,如增加分子量、减缓蛋白酶降解、降低免疫原性、提高生物及化学稳定性等,进而改善其体内药代动力学性质,延长体内半衰期或加速体内的释放,降低中和抗体产生率,提高患者适应性及治疗效果等。鉴于经过改构或修饰的蛋白比未经改构或修饰的蛋白有很多优势,重组蛋白质的改构及修饰必将得到越来越广泛的使用。
三、重组蛋白质药物的生产平台
小分子化药的生产体系依赖于规范的化学中间体和原料药的供应。由于生物技术药物原料药的概念才刚刚出现,其质量标准和产品规范还没有形成,截止目前为止,多数重组蛋白质药物由生物制药公司自己从头生产。
重组蛋白的表达、翻译后修饰及分泌均具有高度复杂性,参与合成的基因数量及是否有糖基化都可影响蛋白质的活性。例如既有由单一基因产生的一条氨基酸链(如生长激素),也有从单一基因经过翻译后由“连接肽”形成的两条相同氨基酸链(同型二聚体)(如α-半乳糖苷酶A)的重组人蛋白衍生物。蛋白还有可能从两种不同的基因产生(如人胰岛素、脑垂体激素、促甲状腺激素、促黄体激素和卵泡刺激素),也可由众多的人类基因片段经过“体细胞重组”过程进行基因重排而得到重组治疗性抗体的高变区域。因此,对于特定的重组蛋白必须选择相对应的某一特定表达体系(例如,细菌与哺乳动物细胞系统)作为生产平台。
目前所有被批准为药物的重组蛋白质,基本上都是由下列4种生产系统生产的:大肠杆菌、酿酒酵母、CHO和BHK细胞,但近5年新批准的重组蛋白药物,多数使用哺乳动物细胞系统,其中CHO的应用更多。通常情况下,某一特定的治疗性蛋白,可以利用两种不同的表达系统生产。例如,胰岛素和人生长激素可以在大肠杆菌或酿酒酵母中表达;IFN-β可在大肠杆菌及CHO细胞中表达。CHO细胞中表达的IFN-β蛋白结构与人类天然蛋白相同,大肠杆菌表达的IFN-β蛋白则是N-末端缺失,一个半胱氨酸被丝氨酸取代,没有任何糖基化。
哺乳类细胞生产体系对软硬件要求均很高,在工业化大规模表达、分离纯化和存储时,蛋白的稳定性、折叠、聚集等可影响蛋白质的生物学活性。另外,生产成本过高及产量不足也是瓶颈,导致重组蛋白药物治疗费远超过普通小分子药物。因此,提高大规模哺乳类细胞的表达水平,优化生产流程及工艺,提高产品质量及产能,降低生产成本将成为重组蛋白质药物产生的重点发展方向。