介绍
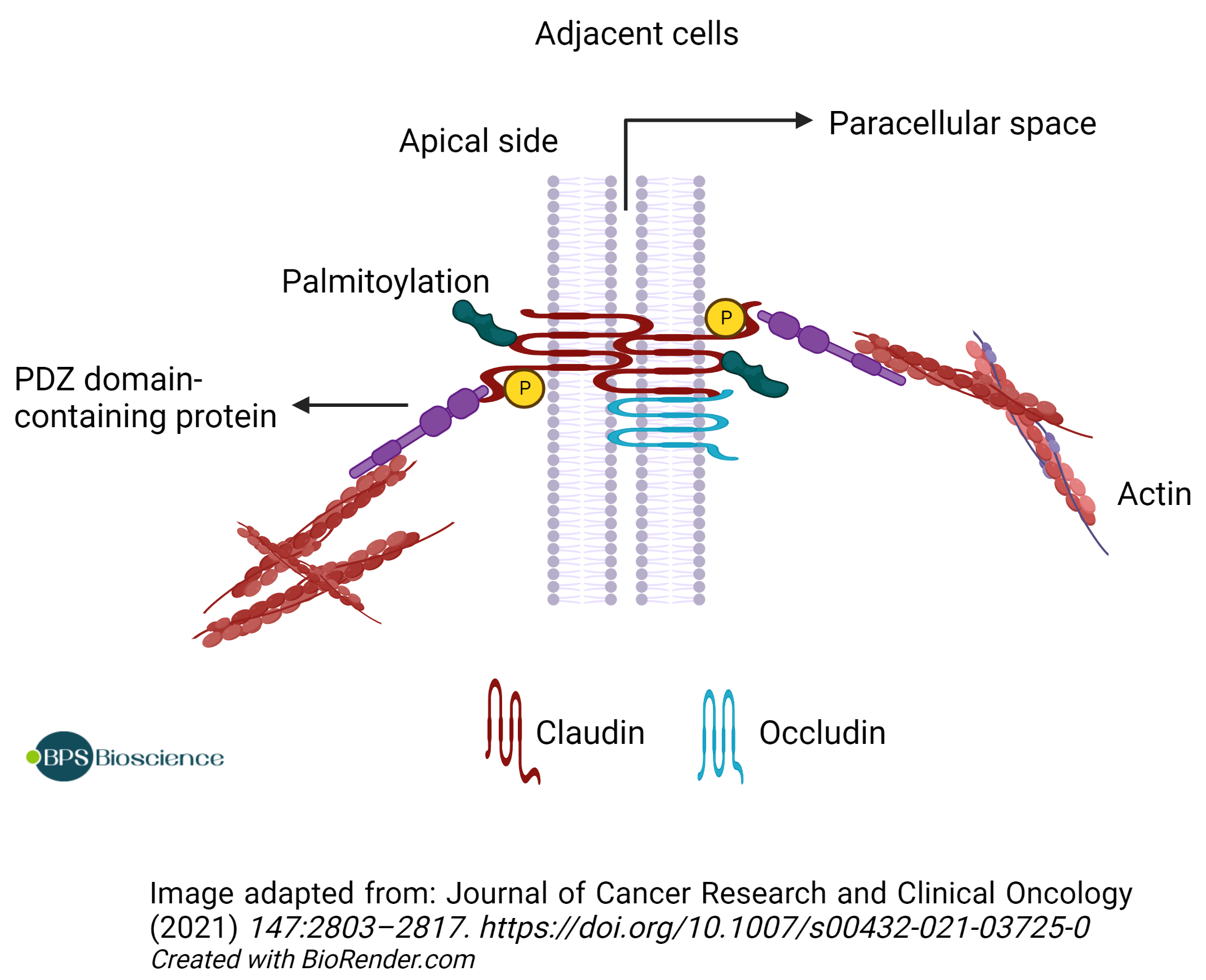
Claudins(由多基因家族 CLDN 编码)是在所有上皮细胞和内皮细胞中发现的四跨膜蛋白。它们作为紧密连接链的关键结构组成部分,其中两个相邻细胞的膜通过自聚合和上皮顶侧膜的跨细胞相互作用连接形成屏障。紧密连接可防止分子在细胞之间传递并保持细胞极性。因此,密蛋白在调节细胞旁通透性以及维持上皮细胞和内皮细胞片中的细胞间粘附中起关键作用 (1, 2)。
1. 人类 Claudin (CLDN) 基因组
在哺乳动物中,CLDN 家族由 24 个基因组成,这些基因表现出组织特异性的表达模式。例如,claudin-7 在小肠和大肠中高度表达,而 claudin-6 在该组织中未观察到。人类和灵长类动物缺乏 CLDN-13 基因,该基因主要在小鼠和啮齿动物中表达 (3)。Claudin-10、claudin-18 和 claudin-19 由于选择性起始位点或剪接而以两种亚型存在,使不同 claudin 蛋白的数量达到 27 个。CLDN 基因很小,包含很少的内含子或完全没有内含子。几对高度同源的 CLDN 基因在人类染色体上彼此靠近 (4)。因此,CLDN6 和 CLDN9 位于 16 号染色体上仅相距 200 个碱基对。同样,4 号染色体上的 CLDN22 和 CLDN24、21 号染色体上的 CLDN8 和 CLDN17 以及 7 号染色体上的 CLDN3 和 CLDN4 都位于彼此 50 kb 以内。这种基因组结构表明,基因复制一直是 claudins 遗传多样化的驱动力。Claudin 家族的系统发育分析显示了基因之间的序列关系,揭示了 CLDN 基因可能是如何进化的 (4, 5)
2. 蛋白质结构
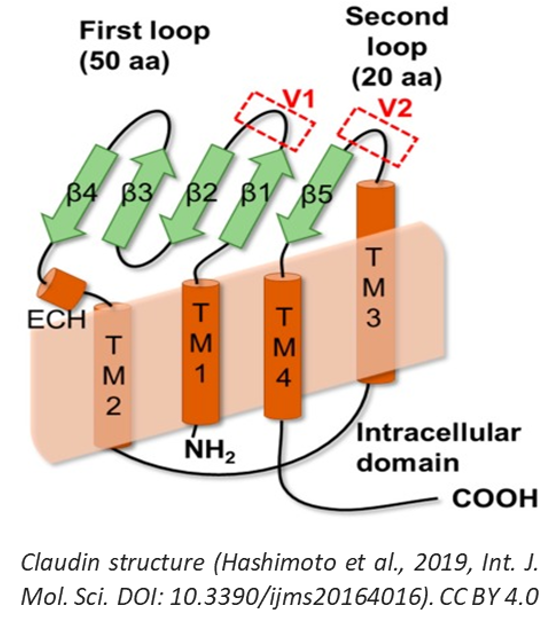
人 claudin 是 21 至 34 kDa 的小蛋白。它们的表达受各种生长因子和细胞因子的转录和转录后调节 (6)。密蛋白的一般结构包括四个跨膜结构域,其中 N 端和 C 端在细胞内延伸到细胞质,以及两个称为 ECL1 和 ECL2 的细胞外环。
N 端序列通常很短,包含大约 5-7 个氨基酸,而 C 端序列的长度变化很大,并且显示出最高的序列异质性。晶体结构表明 ECL 形成反平行β片。ECL1 通常包含四个 β 链和一个胞外螺旋,而 ECL2 由一个 β 链和一个 3d 跨膜跨度的细胞表面暴露结构域组成 (7, 8)。ECL1 内两个高度保守的半胱氨酸残基可形成二硫键以稳定蛋白质构象。ECL1 参与细胞旁途径并决定细胞旁转运的电荷选择性。基于分子建模研究,假设 ECL2 折叠成螺旋-转角-螺旋基序,并通过疏水相互作用参与与相对细胞膜的密蛋白形成二聚体。
3. Claudin 功能的调节
根据序列同源性和 ECL1 结构域中带电残基的数量,Claudins 分为两组(经典和非经典) (5)。功能分析表明,“经典”密棉蛋白可能起到不渗透屏障的作用,降低细胞旁对水和可溶性离子的整体通透性。或者,“非经典”密蛋白可能构成促进选择性离子通透性的孔 (5)。此外,claudin 家族成员可以通过单个细胞内的跨膜结构域(顺式相互作用)和相邻细胞之间的 ECL(反式相互作用)相互相互作用以及与 occludin 家族成员相互作用,从而构建强大而紧密的细胞间连接,根据电荷和大小对离子和小分子具有选择性渗透性 (9)。
细胞质 C 末端结构域包含一个 PDZ 结构域结合基序,允许与包含 PDZ 结构域的支架蛋白直接相互作用。它也是各种翻译后修饰的靶标,例如可能影响蛋白质稳定性/半衰期的棕榈酰化,或调节屏障功能的丝氨酸/苏氨酸和酪氨酸磷酸化(10)。例如,蛋白激酶 A 和 C 对 claudin-3 和 claudin-4 的磷酸化导致细胞旁通透性增加。同样,赖氨酸缺陷蛋白激酶 4 (WNK4) 可以磷酸化多个 claudin 并增加细胞旁通透性 (11)。
4. Claudin 病理生理学
几种人类疾病归因于 CLDN 基因突变。例如,CLDN1 突变导致皮肤进行性脱屑和胆管阻塞,称为新生儿硬化性胆管炎伴鱼鳞病 (12)。CLDN16 表达仅限于肾脏中 Henle 粗升袢的紧密连接处,其中镁和钙被细胞旁重吸收。CLDN16 突变会导致一种罕见的镁消耗性疾病,称为家族性低镁血症 (13)。CLDN19 突变与眼部疾病有关,例如黄斑缺损、眼球震颤和近视。CLDN14 沿耳蜗内上皮表达,当突变时,会导致非综合征性隐性耳聋 (14)。选定的 claudin 家族成员也参与感染的病理学:claudin-1、claudin-6 和 claudin-9 与病毒蛋白相互作用,是丙型肝炎病毒进入的辅助受体 (15),而 claudin-3 和 claudin-4 是肠道中产气荚膜梭菌肠毒素的细胞表面受体 (16)。
最后,claudin 家族的许多成员在癌症中异常表达。Claudin-1 在乳腺癌和结肠癌中下调,而 Claudin-3 和 4 在乳腺癌、前列腺癌、卵巢癌和胰腺癌中高度上调(17 中已论述)。紧密连接在维持上皮完整性方面起着至关重要的作用,紧密连接结构内聚力的丧失会导致癌细胞的侵袭并最终导致癌细胞转移。因此,密蛋白的异常表达可能导致紧密连接紊乱,导致 EMT(上皮-间充质转化),从而影响细胞迁移和转移 (10)。或者,表达水平的改变可能导致细胞旁通透性的变化,从而影响组织生理学和代谢。这些发现与以下事实一致:紧密连接在肿瘤发生过程中被分解,并且密蛋白通常通过激活胞内信号转导级联反应与促进肿瘤增殖和侵袭性有关 (10)。
总体而言,密蛋白表达可能是上皮组织健康和完整性的指标;各种研究将 Claudin 表达作为生物标志物进行了研究。正在使用毒素或毒素片段(如 CPE 的 C 端部分(产气荚膜梭菌肠毒素))靶向组织特异性密蛋白的尝试正在进行中。
| 产品名称 | 货号 | 规格 |
| Anti-claudin-18 lsoform 2 IgG Antibody, Biotin-Labeled | BPS-101565 | 50 µg 100 µg |
| Anti-claudin-18 lsoform 2 Anti-cD3 lgG Bispecific Antibody | BPS-101541 | 50 µg 100 µg |
| Anti-claudin-18 lsoform 2 lgG Antibody | BPS-101564 | 50 µg 100 µg |
| Anti-claudin-18 lsoform 2 Antibody, PE-Labeled | BPS-101676 | 25 µg 100 µg |
| Anti-claudin-18 lsoform 2 Antibody, FlTC-Labeled | BPS-101866 | 25 µg 100 µg |
| 产品名称 | 货号 | 规格 |
| Claudin-6, FLAG-Tag Recombinant | 101599 | 10 µg 100 µg |
| Claudin-18 Isoform 2, FLAG-Tag Recombinant | 101570 | 10 µg 100 µg |
5. Claudin 作为治疗靶点
针对 claudin 的靶向治疗已经获得了很大的关注,尤其是在肿瘤学方面。Claudins 不仅在恶性组织中表达,而且在非恶性组织中表达。然而,非恶性组织中的大多数密蛋白位于紧密连接内,抗体无法接近。上皮组织的恶性转化导致形态改变和细胞间连接受损,使密蛋白暴露在外部环境中。正常组织和肿瘤组织之间的这种差异暴露使 claudins 成为基于抗体的治疗剂的近乎理想的靶标,因为影响健康组织的靶向副作用不太可能发生。
正在开发中针对 claudin 蛋白的各种候选药物:
- 产气荚膜梭菌肠毒素 (C-CPE) 的 C 末端结构域(其中几个密蛋白是细胞表面受体)已被提议作为治疗过表达密蛋白-4 的胰腺癌的潜在抗癌剂 (7)。
- 用于 claudin 靶向治疗的单克隆抗体在初始肿瘤学临床试验中显示出前景 (5)。只要蛋白质可及,抗体就以高亲和力和高特异性与靶蛋白结合。针对 claudin 家族的抗体在肿瘤学、再生医学、炎症性疾病和病毒感染方面具有潜在兴趣 (18)。
第一个进入临床的抗 claudin 抗体 zolbetuximab (IMAB362) 针对 claudin-18 亚型 2。它在胃癌和胃食管交界处 (GEJ) 癌的临床试验中证明了疗效,为抗密蛋白抗体的进一步开发铺平了道路。
结论
人们对 Claudin 家族作为治疗靶点的兴趣一直在稳步增长。为了支持该领域的研究,BPS Bioscience 开发了几种表达 claudin 的细胞系,非常适合在生物学环境中筛选抗 claudin 抗体或 CAR(嵌合抗原受体)构建体。抗密蛋白抗体可用作结合或中和测定中的阳性对照。
引文:
(1) Günzel D, Yu ASL. Claudins and the Modulation of Tight Junction Permeability. Physiol Rev. (2013) 93: 525–569. PMID: 23589827
(2) Angelow S, Ahlstrom R, Yu AS. Biology of claudins. Am J Physiol Renal Physiol. (20080 295(4): F867-876. PMID: 18480174
(3) Thompson PD, et al. Claudin 13, a Member of the Claudin Family Regulated in Mouse Stress Induced Erythropoiesis. PLoS ONE (2010) 5(9): e12667. PMID: 20844758
(4) Lal-Nag M, Morin PJ. The claudins. Genome Biol (2009) 10: 235. PMID: 19706201
(5) Baltzegar DA, et al. Phylogenetic revision of the claudin gene family. Mar Genomics. (2013) 11: 17-26. PMID: 23726886 (6) González-Mariscal L, et al. Crosstalk of tight junction components with signaling pathways. Biochim Biophys Acta. (2008) 1778(3): 729-756. PMID: 17950242
(7) Hashimoto Y, et al. Potential for Tight Junction Protein-Directed Drug Development Using Claudin Binders and Angubindin-1. Int J Mol Sci. (2019) 20(16): 4016. PMID: 31426497
(8) Suzuki H, et al. Model for the architecture of claudin-based paracellular ion channels through tight junctions. J Mol Biol. (2015) 427(2): 291-297. PMID: 25451028
(9) Furuse M, et al. Manner of interaction of heterogeneous claudin species within and between tight junction strands. J Cell Biol. (1999) 147(4): 891-903. PMID: 10562289
(10) Bhat AA, et al. Tight Junction Proteins and Signaling Pathways in Cancer and Inflammation: A Functional Crosstalk. Front Physiol. (2019) 9: 1942. PMID: 30728783
(11) Yamauchi K, et al. Disease-causing mutant WNK4 increases paracellular chloride permeability and phosphorylates claudins. Proc Natl Acad Sci USA. (2004) 101(13): 4690-4694. PMID: 15070779
(12) Hadj-Rabia S, et al. Claudin-1 gene mutations in neonatal sclerosing cholangitis associated with ichthyosis: a tight junction disease. Gastroenterology. (2004) 127: 1386-1390. Erratum in: Gastroenterology. 2005 Feb;128(2):524. PMID: 15521008
(13) Simon DB, et al. Paracellin-1, a renal tight junction protein required for paracellular Mg2+ resorption. Science. (1999) 285(5424): 103-106. PMID: 10390358
(14) Wilcox ER, et al. Mutations in the gene encoding tight junction claudin-14 cause autosomal recessive deafness DFNB29. Cell. (2001) 104(1): 165-172. PMID: 11163249 (15) Evans MJ, et al. Claudin-1 is a hepatitis C virus co-receptor required for a late step in entry. Nature. (2007) 446(7137): 801-805. PMID: 17325668
(16) Katahira J, et al. Clostridium perfringens enterotoxin utilizes two structurally related membrane proteins as functional receptors in vivo. J Biol Chem. (1997) 272(42): 26652-26658. PMID: 9334247
(17) Li J. Dysregulated expression of claudins in cancer. Oncol Lett. (2021) 22(3): 641. PMID: 34386063 (18) Hashimoto Y, et al. Claudin-Directed Drug Development. J. Pharm. Exp. Ther. (2019) 368 (2): 179-186. PMID: 30530622