精确的蛋白质定量是蛋白质相关实验所必需的,这些实验涉及分子生物学,细胞生物学,生物化学,发育生物学和神经科学的研究课题。依托不同的科学原理,目前已经发展出多种不同的蛋白测定方法,科研工作者广泛使用的方法比如紫外吸收法(UV),双缩脲法,考马斯亮蓝法(Bradford)、Folin-酚试剂法(Lowry)、BCA(Bicinchoninic Acid)法、凯氏定氮法等等,各有千秋。今天小编就BCA法,Bradford法,2种常见蛋白定量方法的原理、优缺点以及BCA法实验操作步骤给大家做详细介绍,看看哪一种方法能获得你的支持?
BCA(Bicinchoninic Acid)法
1、原理:
BCA (bicinchonininc acid)与二价铜离子的硫酸铜等其他试剂组成的试剂,混合一起即成为苹果绿,即BCA工作试剂。在碱性条件下,BCA与蛋白质结合时,蛋白质将Cu2+还原为Cu+,一个Cu+螯合二个BCA分子,工作试剂由原来的苹果绿形成紫色复合物,562nm处有最高的吸收值,可在540-595nm测定其吸收值,颜色的深浅与蛋白质浓度成正比,与标准曲线对比,即可计算待测蛋白的浓度。
2、特点:
- BCA蛋白质测定方法灵敏度高,操作简单,正常情况下可在45分钟内完成测定;且试剂及其形成的颜色复合物稳定性俱佳。不方便的是这种方法需要提前制作标准曲线。
- 灵敏度:例如Abbkine的定量总蛋白的蛋白质定量试剂盒(BCA法),线性标准曲线范围为50-1000 ug/ml,灵敏度25ug/ ml,最低检测蛋白量达到5ug。
- 优点:BCA方法适用于表面活性剂存在下的蛋白质浓度检测,可兼容高达5%的SDS,TritonX-100及Tween等。
- 缺点:由于BCA方法依靠铜离子进行显色反应,如果溶液中含有与铜离子反应的螯合剂比如EDTA或者还原性试剂比如DTT、TCEP和β-巯基乙醇等,结果将受到很大程度的影响。此外,BCA方法的检测结果也会受到蛋白质内半胱氨酸,酪氨酸,色氨酸含量的影响。
3、实验所需仪器及试剂:
恒温水浴锅、可见光分光光度计、离心机、旋涡混合器、试管
4、实验操作:
- 标准液制备:梯度稀释牛血清白蛋白(BSA)标准品。将8个EP管按照1到8进行标记,将BSA标准品稀释成1mg/mL工作液,准备浓度梯0,50,100,200,400,600,800,1000 ug/mL。
- BCA工作液制备:将A液和B液摇晃混匀,按照A:B=50:1的比例配置BCA工作液,充分混匀。(BCA工作液室温下24h内稳定,故现用现配)
- 加样孵育:吸取20μL各个稀释浓度的蛋白质标准品或待测蛋白质样品,加入96孔板底部或试管中,向孔/管中再加入200uL BCA工作液轻轻摇晃混匀。在37°C下孵育30min,冷却至室温。
- 测定:冷却到室温后,以空白为对照,测量样品在562nm或该波长附近的吸光值
- 将各个标准品和待测蛋白质样品在562nm处的吸光值减去空白标准品在562nm处的平均吸光值。
5、浓度计算:
- 在excel表中输入对应的标准曲线值和蛋白样品值。(图中所示均为举例说明,具体数据请参照个人实际实验结果),选定标准曲线的OD值和标准品蛋白浓度。
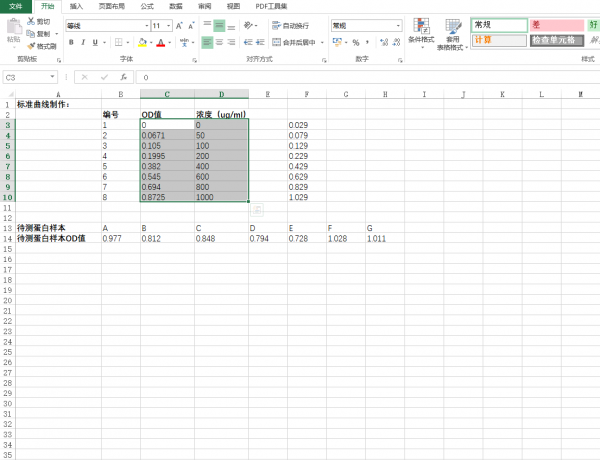
- 点击excel表栏:插入-图表-XY散点图,并点击确定。
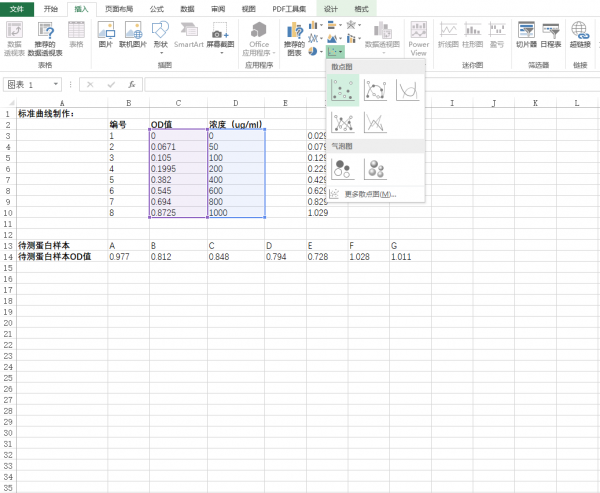
- 点击确定后会自动生成XY散点图,随意点击散点图中的任一的散点,右键添加趋势曲线。
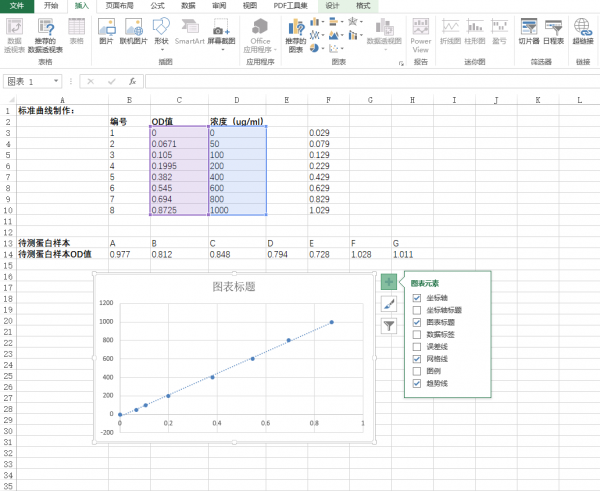
- 点击趋势线的拓展栏,选择“更多选项”
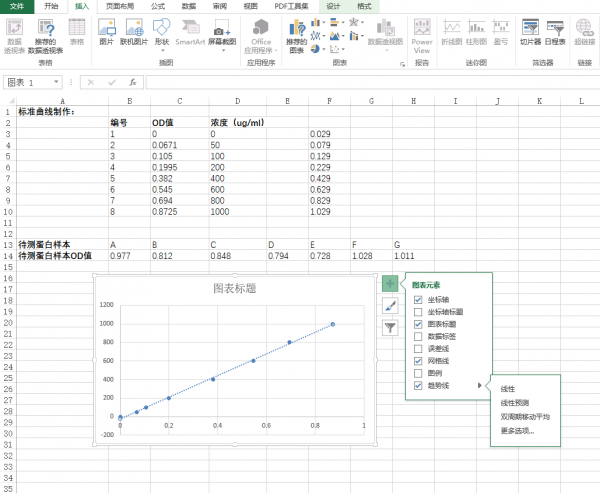
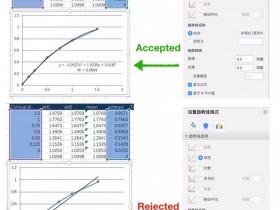
- 选择“更多选项”,弹出“设置趋势图格式”的画面,点击“显示公式(E)”以及“显示R平方值”。一般R2值越接近1,表现标准曲线做得越好,根据标准曲线带入的样品OD值测出的蛋白浓度也越准确,一般要求为0.99几左右。
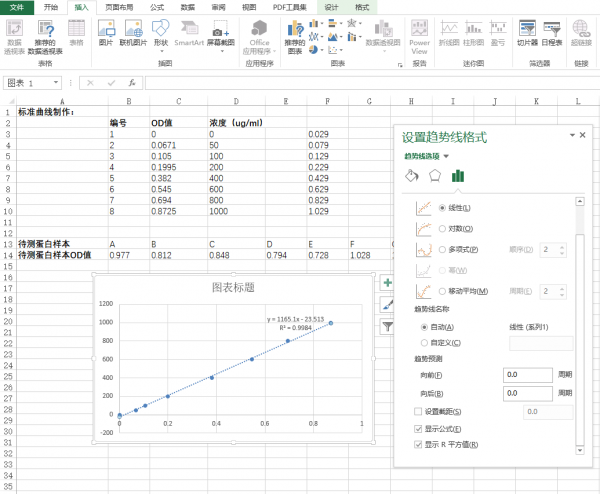
- 将样品OD值代入标准曲线的公式中,计算即得到待测样品蛋白的浓度。
考马斯亮蓝法(Bradford)
1、原理:
Bradford法也称作考马斯亮蓝法,是由Bradford于1976年建立的。该方法的原理是,带负电的考马斯亮蓝染料与蛋白质中碱性氨基酸相互作用。考马斯亮蓝G250(Coomassie brilliant blue G250),是一种甲基取代的三苯基甲烷,在酸性溶液中与蛋白质结合,使染料的最大吸收峰的位置(lmax),由465nm变为595nm,溶液的颜色也由游离状态下的棕红色变为蓝色。并且在一定浓度范围内,稳定的染料-蛋白复合物的OD值与蛋白质含量呈线性关系。通过分光光度计或者酶标仪以标准品蛋白做标准曲线,随后检测目标蛋白595nm波长处的吸光值,即可换算出目标蛋白浓度。
2、特点:
- 简单便捷:仅需一种反应试剂即可完成检测,操作十分便捷,完成一个样品的测定只需要5分钟左右。由于染料与蛋白质结合的过程,大约只要2分钟即可完成,其颜色可以在1小时内保持稳定,且在5分钟至20分钟之间,颜色的稳定性最好,不用考虑时间的限制。
- 灵敏度:例如Abbkine的蛋白质定量试剂盒(Bradford法),线性标准曲线范围为50-1000 ug/ml,灵敏度25ug/ ml,最低检测蛋白量达到5ug。反应非常灵敏,灵敏度比Lowry法还高4倍,可测定微克级蛋白质含量。
- 优点: Bradford 法测定蛋白浓度不受绝大部分样品中的化学物质的影响,如:K+ 、Na+ 、Mg2+离子、Tris缓冲液、糖和蔗糖、甘油、EDTA、DTT、TCEP 和β-巯基乙醇等。
- 缺点:由于蛋白-染料稳定复合物之间是分子间作用力,故Bradford法会受到表面活性剂如:去污剂、1N的NaOH 、SDS、Triton X-100,Tween 20等的干扰。除此之外,不同靶标蛋白中碱性氨基酸(范德华力作用)以及芳香族氨基酸(疏水作用)含量不一,对考马斯亮蓝的结合能力差异较大;而且随着蛋白浓度增加,线性关系会出现偏差。
注意:
- 由于高浓度洗涤剂会影响检测结果的可靠性,必须确保样品中的SDS的浓度低于1%,Triton X-100低于0.1%,Tween 20,60,80低于0.06%。
- 检测蛋白浓度的考马斯亮蓝和染色PAGE胶的考马斯亮蓝不是同一种物质,前者采用考马斯亮蓝G250,后者采用考马斯亮蓝R250,G250和R250分子基本骨架一样,但是G250多了两个甲基,与蛋白反应迅速,染胶慢且脱色困难,故用于蛋白定量;R250与蛋白反应较缓慢,染胶较快且易于洗脱,故用于PAGE胶染色。
通过以上两种蛋白定量的方法的对比,我们可以发现对于BCA法和Bradford法,每一种方法都有自身的优势和缺陷,因此针对同一样本采用不同的方法进行检测,检测结果也可能出现偏差。所以我们在使用时,应当根据实验条件挑选最合适的检测方法,这样实验数据才会更可靠!
产品推荐:
| 名称 | 货号 | 规格 |
| 蛋白质定量试剂盒(BCA法) | KTD3001 | 500T/2000T/5000T |
| 蛋白质定量试剂盒(Bradford法) | KTD3002 | 500T/2000T/5000T |
Abbkine专注于蛋白学和细胞学领域,致力于创新和研发各类抗体、蛋白质、分析试剂与试剂盒,以期成为生命科学研究发展、药物研发等领域的关键推动者。我们为您提供蛋白和免疫研究用户最喜爱的产品,从免疫学基础产品,如蛋白提取定量,到免疫学实验的内参标签抗体、一抗及二抗等;细胞研究用户最喜爱的产品,从用于检测细胞状态的染料及试剂盒,细胞器提取试剂盒,细胞亚结构染色示踪及细胞代谢检测产品,到用于细胞培养的细胞因子及蛋白类检测试剂盒,只为助力您的研究事业!
相关热门文章阅读:蛋白定量BCA法 VS Bradford法,你支持哪一种?
http://www.abbkine.cn/protein-quantification-bca-bradford