1、《科学》: 鲸鱼形成巨大体型的原因与生态限制
近日,来自美国斯坦福大学J. A. Goldbogen等研究人员在《科学》上发表了题为“Why whales are big but not bigger: Physiological drivers and ecological limits in the age of ocean giants.”,的研究结果,揭示出鲸鱼形成巨大体型的原因与生态限制。
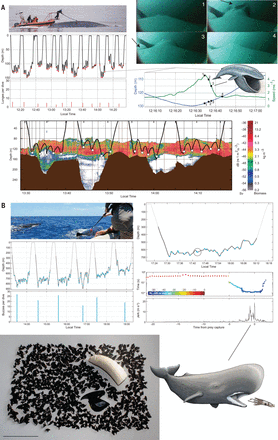
Fig. 1 Whale tag data quantifies foraging performance.
研究人员测量了饲喂性能和猎物质量,以证明捕食者丰度和收获机制之间的相互作用如何驱动巨人鲸活动,从而增加了猎物的捕获率和能量摄入。以单个猎物为食的带齿鲸的觅食效率受到大型猎物的丰富性的限制,而以滤食为基础的鲸鱼则季节性地以高效率捕捞大量小猎物。给定在时间和空间上聚集的猎物,滤食提供了一种进化途径,从而可以达到极端的体形,而这对于必须一次捕食一个猎物的类型来说是不可行的。滤食动物的最大尺寸可能受空间和时间范围内猎物可用性的限制。
据了解,最大的动物是海洋滤食动物,但其大尺寸的潜在机制仍无法解释。
(评论:海洋有大量的美食,这跟吃得多长得更大一个道理哈哈哈(逃~))
文章来源:
J.A. Goldbogenet al,Why whales are big but not bigger: Physiological drivers and ecological limits in the age of ocean giants.DOI: 10.1126/science.aax9044, Science,最新IF:41.037
近日,来自瑞典皇家理工学院Joakim Lundeberg、Michaela Asp等研究人员在期刊《细胞》发表了题为“A Spatiotemporal Organ-Wide Gene Expression and Cell Atlas of the Developing Human Heart”的研究结果,合作绘制了人类心脏发育的时空器官尺度基因表达和细胞图谱。
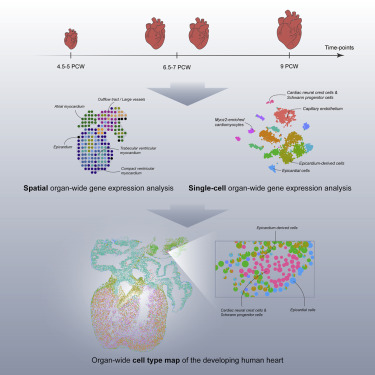
研究人员提出了一种分子方法,揭示了在三个发育阶段填充胚胎心脏细胞类型的全面转录概况,并将细胞类型特异性基因表达映射到特定的解剖结构域。空间转录组学确定了与每个发育阶段中不同的解剖区域相对应的独特基因谱。通过单细胞RNA测序鉴定的人类胚胎心脏细胞类型证实并丰富了胚胎心脏基因表达的空间注释。然后使用原位测序来完善这些结果,并为三个发育阶段创建空间亚细胞图谱。最后,研究人员创建了人类心脏发育的公开访问网络资源,以促进人类心脏发生的未来研究。
据介绍,人类心脏形态发生的过程尚未完全了解。其完整特征要求深入研究具有单细胞空间分辨率基因表达的全器官模式。
(评论:虽然不能完全了解,但还是厉害的,学习了)
文章来源:
Michaela Asp et al, A Spatiotemporal Organ-Wide Gene Expression and Cell Atlas of the Developing Human Heart. DOI: 10.1016/j.cell.2019.11.025 Cell,最新IF:36.216
3、《自然》:RIPK1突变可引起自身免疫疾病
近日,来自澳大利亚墨尔本大学John Silke与美国国立卫生研究院Daniel L. Kastner、等研究人员合作在期刊《自然》上发表了题为“Mutations that prevent caspase cleavage of RIPK1 cause autoinflammatory disease.”,发现RIPK1的剪切位点突变可引起自身免疫疾病。
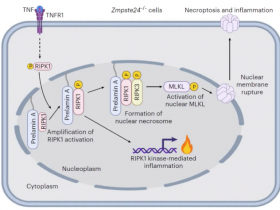
研究人员发现,杂合的错义突变D324N、D324H和D324Y可以阻止人类中RIPK1的半胱天冬酶剪切,并导致早发性周期性发热综合征和严重的间歇性淋巴结病,研究人员将这种情况称为“抗剪切性RIPK1诱导的自体炎症综合征”。
为了定义这种疾病的机制,研究人员产生了抗剪切的Ripk1D325A突变小鼠品系。Ripk1-/-小鼠死于全身性炎症,而Ripk1D325A/D325A小鼠则在胚胎发生过程中死亡。Casp8和Ripk3的联合缺失可以完全防止胚胎致死,但不能单独通过Ripk3或Mlkl的缺失来预防。RIPK1激酶活性的丧失也阻止了Ripk1D325A/D325A胚胎致死性,尽管这些小鼠在断奶之前以依赖RIPK3的方式从多器官炎症中死亡。
一致地,Ripk1D325A/D325A和Ripk1D325A/+细胞对依赖RIPK3的TNF诱导的细胞凋亡和坏死敏感。杂合的Ripk1D325A/+小鼠能够存活并大体正常,但对体内的炎症刺激反应过度。这些结果表明,caspase 介导的RIPK1剪切在胚胎发育过程中的重要性,并表明RIPK1的caspase剪切不仅抑制了坏死,而且在整个生命过程中都参与维持炎症稳态。
据悉,RIPK1是先天性免疫信号通路的关键调节因子。为了确保最佳的炎症反应,RIPK1通过已知的泛素化和磷酸化转录后修饰以及caspase-8介导剪切的来调节。尽管人们认为这种剪切事件会抑制RIPK3的激活与坏死,但其在生理上的相关性仍不清楚。
(评论:学习了)
文章来源:Najoua Lalaoui et al, Mutations that prevent caspase cleavage of RIPK1 cause autoinflammatory disease. DOI: 10.1038/s41586-019-1828-5. Nature、 最新IF:43.07