鞘脂代谢(Sphingolipid metabolism)是生物体内一类复杂脂质分子的合成、分解及调控过程,其核心结构是以鞘氨醇(sphingosine)为骨架的脂类化合物,包括神经酰胺(ceramide)、鞘磷脂(sphingomyelin)和糖鞘脂(glycosphingolipids)等。这些分子不仅是细胞膜的重要组成成分,还通过动态代谢网络参与细胞信号传导、凋亡调控、炎症反应及能量稳态维持等关键生理过程。鞘脂代谢的核心枢纽是神经酰胺,其合成由丝氨酸棕榈酰转移酶(SPT)启动,经多步反应生成,而神经酰胺可通过磷酸化、糖基化或水解转化为其他活性代谢物。近年研究发现,鞘脂代谢失衡与多种疾病密切相关,例如神经退行性疾病中神经酰胺异常积累、代谢综合征中鞘脂介导的胰岛素抵抗,以及肿瘤细胞通过鞘脂重塑逃逸凋亡等。随着质谱技术和基因编辑的进步,鞘脂代谢网络的空间-时间动态调控机制逐渐明晰,相关酶类如鞘磷脂酶、神经酰胺合成酶等成为药物研发的新靶点。深入研究鞘脂代谢对揭示疾病机制和开发精准疗法具有重要意义。
1.鞘脂代谢与哪些疾病、病理特点和“热点有关?
在神经系统疾病中,如阿尔茨海默病、帕金森病和多发性硬化症,鞘脂代谢失调会影响神经细胞的信号传导和存活;代谢性疾病如肥胖、糖尿病和心血管疾病也与鞘脂代谢紊乱有关,表现为细胞内脂质堆积和炎症反应。此外,在癌症中,鞘脂代谢途径可能促进肿瘤细胞增殖和耐药性;遗传性神经病变如尼曼-皮克病和法布里病则是由于鞘脂代谢酶缺陷导致脂质积累。
另外,鞘脂代谢失调可引发细胞凋亡、自噬异常、炎症反应以及细胞间信号传导障碍。因此,鞘脂代谢是连接细胞生理与多种疾病发生发展的重要环节。
2.鞘脂代谢的过程以及作用有哪些?
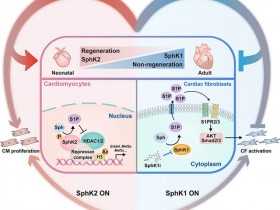
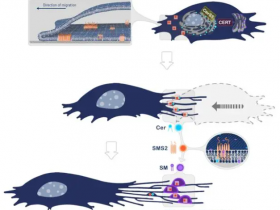
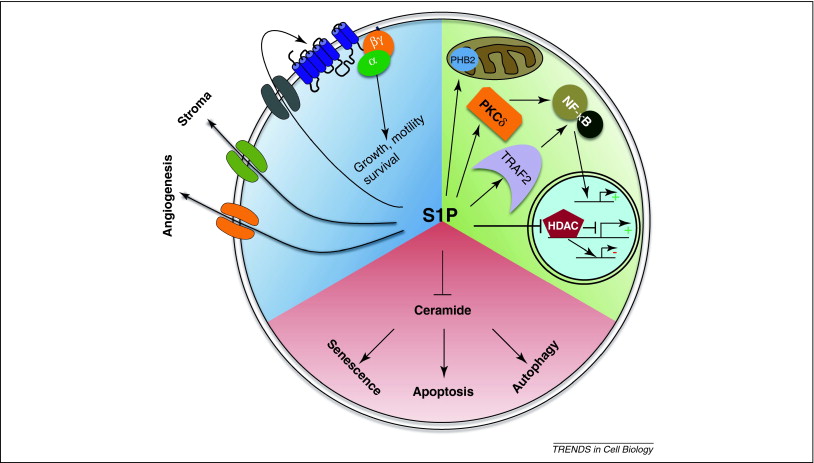
鞘脂代谢的空间分布和区域化。鞘脂的从头合成始于内质网,生成神经酰胺(Cer),随后通过不同途径转化为鞘磷脂(SM)、糖鞘脂(GSLs)或被运输至线粒体。在细胞膜,神经酰胺可被转化为鞘氨醇(Sph)或鞘氨醇-1-磷酸(S1P)。
S1P可被分泌并激活S1P受体(S1PRs),调节多种信号通路(你猜会不会参与细胞-细胞间交互?)。此外,S1P在细胞核中调节组蛋白乙酰化(你猜会不会调控基因转录?),在线粒体中影响电子传递链(你猜会不会影响线粒体功能、ROS、炎症反应……)。
鞘脂代谢涉及的关键基因包括:
合成相关:SPTLC1/2/3、CerS1-6、DES1;
转化相关:ASPAH、SGPL1、SphK1/2、SGPL1;
降解相关:SMPD1/2/3、GLB1;
转运相关:CERT、SPNS2;
调节相关:ORMDL1/2/3、ACER1/2/3。
这些基因在鞘脂代谢中发挥重要作用,其异常与多种疾病相关。
3. 鞘脂代谢相关研究的文献
研究揭示了IL-10通过调控鞘脂代谢限制炎症的关键机制。研究发现,IL-10缺失导致饱和型超长链神经酰胺(VLC ceramides)积累,引发过度炎症基因表达。Cers2基因(编码VLC神经酰胺合成酶)的缺失可显著抑制这种炎症反应。机制上,IL-10通过促进单不饱和脂肪酸合成,抑制VLC神经酰胺积累和REL转录因子活性,进而控制炎症。研究还表明,恢复单不饱和脂肪酸水平可缓解IL-10缺失引起的炎症。
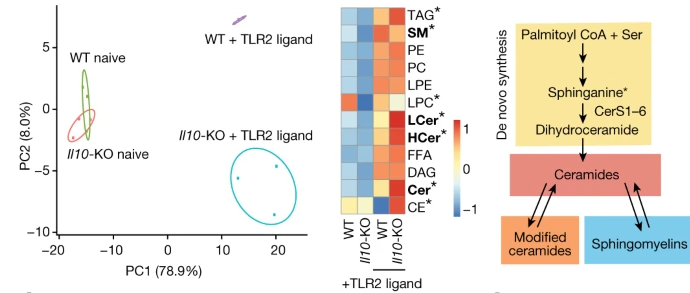
文章来源:“IL-10 constrains sphingolipid metabolism to limit inflammation.”PMCID: PMC10954550 DOI: 10.1038/s41586-024-07098-5,
2) BMj :FTO缺乏破坏CerS6介导的鞘脂代谢可加重溃疡性结肠炎
发现FTO在溃疡性结肠炎(UC)患者中表达下调,通过影响鞘脂代谢加剧结肠炎。FTO缺失导致CerS6基因的m⁶A修饰增加和mRNA稳定性降低,进而使CerS6表达下调,引起IEC(肠上皮细胞)中S1P(鞘氨醇-1-磷酸)积累。IEC分泌的S1P激活促炎性巨噬细胞分泌血清淀粉样蛋白A1/3,诱导Th17细胞分化,加重炎症。
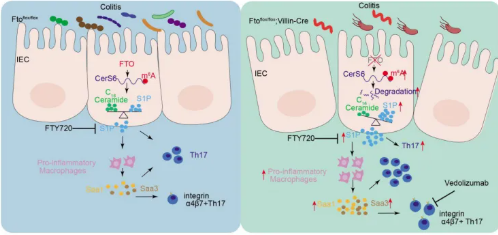
文章来源:“Disruption of CerS6-mediated sphingolipid metabolism by FTO deficiency aggravates ulcerative colitis.”doi: 10.1136/gutjnl-2023-330009.
3) AHAlASA:重组内皮鞘脂代谢以有利于S1P而非神经酰胺预防冠状动脉粥样硬化
研究发现,在冠状动脉粥样硬化中,血流动力学应激可诱导内皮细胞鞘脂代谢重编程,促进S1P合成,减少神经酰胺积累,从而发挥保护作用。NOGO-B通过抑制SPT调节鞘脂代谢,其在ApoE⁻/⁻小鼠内皮细胞中表达上调。敲除NOGO-B的小鼠表现出对冠状动脉粥样硬化的抵抗性,纤维帽增厚,坏死核心和巨噬细胞浸润减少。机制上,NOGO-B缺失维持了鞘脂代谢向S1P的重编程,赋予内皮细胞抗动脉粥样硬化的转录特征。
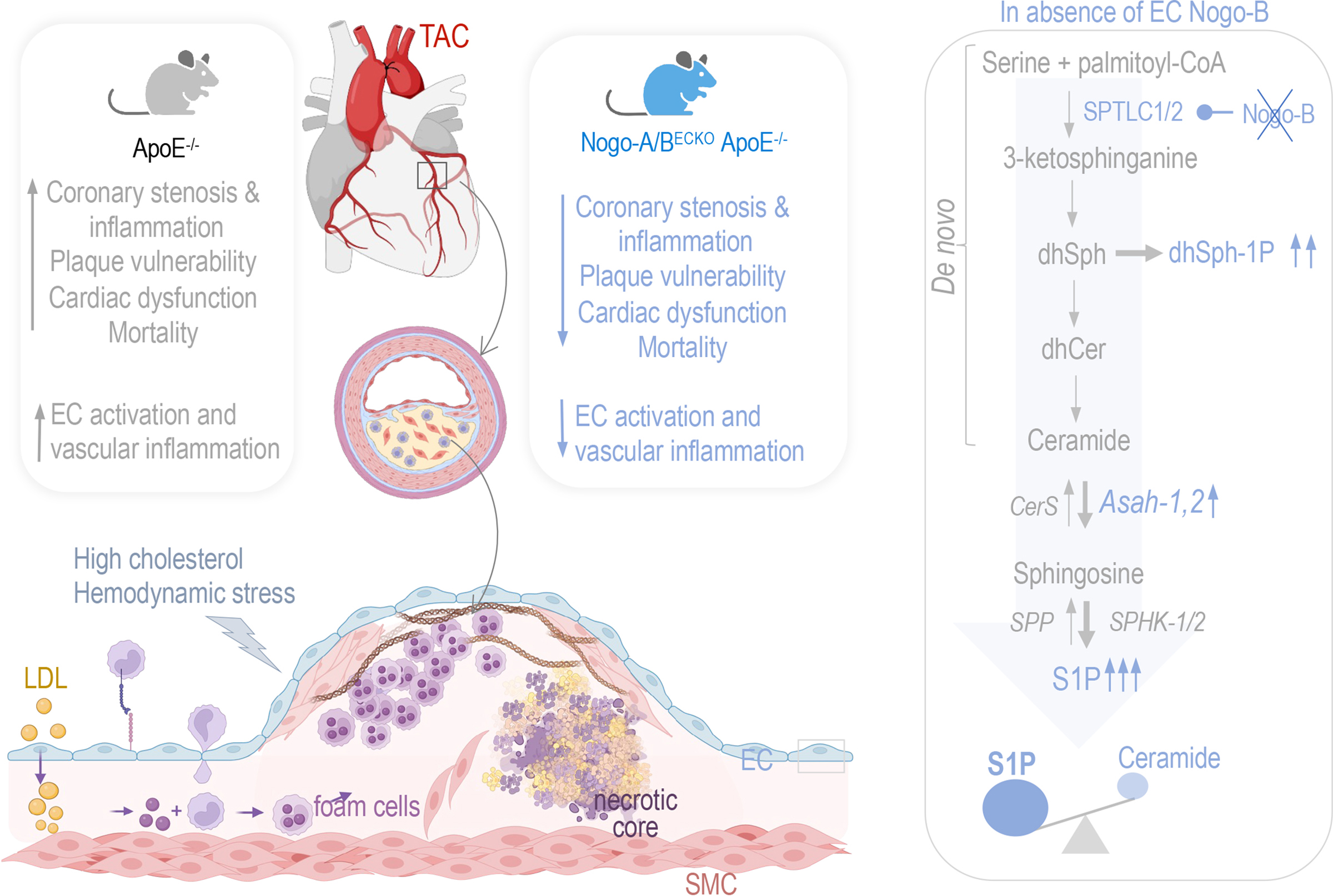
文章来源:“Rewiring Endothelial Sphingolipid Metabolism to Favor S1P Over Ceramide Protects From Coronary Atherosclerosis.“ doi: 10.1161/CIRCRESAHA.123.323826.