在前面的《很火很厉害的iTRAQ定量蛋白质组学技术》一文中我们提到:常用的定量蛋白质组学的研究方法有DIGE(difference gel electrophoresis)、iCAT(Isotope-coded affinity tag)、SWATH(Sequential Windowed Acquisition of all Theoretical fragment ions)、SILAC(Stable Isotope Labeling with Amino Acids in Cell Cultures)和iTRAQ(isobaric tags for relative and absolute quantitation)。现在我们再给大家介绍一种同样热门的的定量蛋白质组学技术-SILAC(Stable Isotope Labeling with Amino Acids in Cell Cultures)。
2002年,丹麦Mann实验室的Ong等对AACT技术作了进一步改进,建立了SILAC技术并首次应用于定量蛋白质组研究,为全面、系统地定性和定量分析复杂哺乳动物细胞蛋白质组提供了有效的方案。
SILAC技术的原理
SILAC的基本原理是分别用天然同位素(轻型)或稳定同位素(重型)标记的必需氨基酸取代细胞培养基中相应氨基酸,细胞经5-6个倍增周期后,稳定同位素标记的氨基酸完全掺入到细胞新合成的蛋白质中替代了原有氨基酸。这样,两个蛋白之间就存在分子量的改变,而其它化学性质无异。最初SILAC 使用的标记氨基酸是氚代甲硫氨酸和氘代甘氨酸,目前常用的标记氨基酸有亮氨酸、精氨酸、赖氨酸、甲硫氨酸和酪氨酸等。
不同标记细胞的裂解蛋白按细胞数或蛋白量等比例混合,提取出蛋白质组,并交给质谱去测定。每个肽段作为质谱中的一对——低分子量的肽段含有轻型氨基酸,来源于A组,高分子量的肽段则含有重型氨基酸,来源于B组。如果SILAC肽段对呈现1:1的比例,则蛋白质组中此蛋白的丰度无差异。如果含有重型氨基酸的肽段峰强度偏高,则说明B组中蛋白丰度更高。因为稳定同位素标记的氨基酸与天然氨基酸的化学性质基本相同,除了分子量差异,则质谱上峰强度的比值直接对应了A组与B组的比例。虽然整个实验的时间主要取决于细胞生长的速率和所采用的各种样品处理步骤,但一般来说,SILAC实验从开始到结束,包括数据分析,大约需要20到25天。
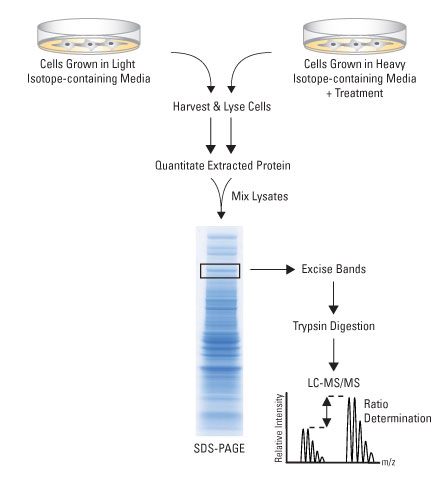 SILAC的流程(图片来自赛默飞世尔)
SILAC的流程(图片来自赛默飞世尔)
经典的SILAC实验
2007年,Matthias Mann教授在《Nature Protocols》上发表了经典SILAC实验的流程。2-3个样品被分别标记,并在质谱分析中直接比较。来自不同样品的等量细胞或细胞裂解液混合,并在后续步骤中作为单个样品来处理。这样可使用任一种蛋白或肽段富集方法,也不会担心在最后的定量分析中引入定量误差。
经典的SILAC实验(也就是double-SILAC)比较2个或3个样品,但是通过两个triple-SILAC实验,也可以比较5个样品,注意,这两个实验至少有一个共同样品。这在时间进程实验中比较常用。在double-SILAC中,MaxQuant(马普开发的软件包)确定“重型”和“轻型”的肽段比例,而在triple-SILAC中,它确定“重型”与“中等”、“中等”与“轻型”以及“重型”与“轻型”的比例。
动物体的SILAC实验
2008年,Mann的小组及其他小组的研究表明,SILAC也能用于整个小鼠的同位素标记。Mann小组通过给小鼠提供含有13C6赖氨酸的饲料,将SILAC方法拓展应用于体内研究。通过对小鼠饮食、生长发育、生育能力、活动和生理情况的观测,发现SILAC标记对小鼠后几代都无不利影响。在F2代小鼠体内,他们观察到13C6赖氨酸几乎标记了体内所有器官的蛋白质,使得对这一代和以后若干代小鼠进行定量的蛋白质分析成为可能。
Krüger等人采用了三种基因表达缺陷的小鼠模型对上述方法进行了验证。在每个实验中,差异标记野生型小鼠和基因表达缺陷的小鼠,然后通过质谱检测明确证实了相关组织中相应蛋白质的表达缺失。他们的研究结果表明,体内SILAC标记方法是一种多功能工具,能定量比较缺陷小鼠的蛋白质组,从而确定体内复杂环境中的蛋白功能。
而线虫的定量蛋白质组分析也开展得如火如荼。两个小组都采用氨基酸的稳定同位素标记(SILAC)方法,开展了线虫的定量蛋白质组实验,文章发表在同一期的《Nature Methods》上。
英国邓迪大学的Mark Larance等改良了SILAC方法,用一种重型赖氨酸和重型精氨酸标记的大肠杆菌喂养线虫。质谱分析表明F1后代中已掺入重型精氨酸和赖氨酸。同时,他们还采用RNAi via feeding策略,靶定了精氨酸-脯氨酸转化过程中必需的鸟氨酸转氨酶基因orn-1。质谱结果表明,这种策略几乎完全避免了精氨酸-脯氨酸的转化。将此方法与定量蛋白质组方法相结合,研究人员还鉴定了线虫的热击反应。
几乎同时,南丹麦大学生物化学与分子生物学系的Julius Fredens等也使用了非常相似的方法。他们用重型同位素标记的大肠杆菌喂养线虫,得到了重型同位素赖氨酸标记的线虫。利用标记的线虫和定量蛋白质组方法,他们鉴定出一些蛋白,响应了线虫核激素受体49(NHR-49)的功能丧失。
作者认为,他们的SILAC方法为线虫的定量蛋白质组研究带来了很多机会。没有了精氨酸-脯氨酸的转化,SILAC实验可更高效地开展。SILAC技术还能协助确定线虫发育、衰老以及压力过程中的整体蛋白质组变化。定量蛋白质组学与选择性基因敲除的结合使用,是研究线虫的一种强有力工具。
SILAC技术的优势
SILAC方法有很多优势。
- 高效性:细胞在传代6-8代之后,蛋白标记效率可达90%以上。
- 定量精确:标记是在样品处理前引入,随后进行蛋白质分离、酶切和鉴定,后续实验对样品的影响一致,故样品处理所带来的定量误差(bias)会很低。在检测极低水平的蛋白变化或翻译后修饰时,这一点特别有用。
- 高通量:可同时鉴定并定量数百至数千种蛋白质
- 高灵敏度:SILAC灵敏度高,样本量要求少,通常每个样品只需要几十微克的蛋白量。
- 相容性:可对多种在DMEM或RPMI 1640培养基中能够培养的细胞或细菌中表达的蛋白进行标记








